原子・電子
J.J.トムソンという人が陰極線が電界によって曲げられることから、負の電荷を持った「電子」という粒子が存在していることを発見した。ならば、物質全体は電気的につりあってなければならないから、正の電荷を持った粒子があるはずだ。正の電荷同士は斥力を持つから固まって存在できるはずはないから、原子の内部には静電荷と負電荷がばらばらに存在していると考えた(「ぶどうパン」モデル)。
ラザフォードは金箔にα粒子をぶち当ててこれを証明しようとした。「ぶどうパン」モデルなら、正負の電荷が空間に均等に配置しているから、正の電荷を持つα粒子も曲げられずに直進して透過するはずだ。実際ほとんどはそうなった。ところが約2万個に1個の割合で跳ね返されてくるα粒子があった。α粒子はヘリウム原子核で電子の7000倍の質量を持っている。そんな重たいものに弾き飛ばされず、逆に跳ね返すことができるとは、原子の中にある正電荷を持った粒子は相当大きな質量を持っていなければならない。かつ、大部分のα粒子が通り抜けたということは、原子の中の大部分の空間が「なにもない」ことになる。
で、原子というのは校庭の真ん中に置かれたピンポン玉にたとえられるきわめて小さな原子核にその大部分の質量が集中しているという奇妙な構造を持っていることが明らかになった。
| 原子核 | 核外 | ||
| 陽子(p+) | 中性子(n) | 電子(e-) | |
| 電荷 | +e | 0 | -e |
| 質量比 | 1850 | 1850 | 1 |
原子核は、正の電荷を持った陽子と電荷を持たない中性子からできている。これらの質量はほぼ等しく、核外電子の約1850倍である。したがって、原子の質量はそのほとんどが、原子核に集中しているといってよく、また、陽子および中性子の「個数」の整数倍に近い値になるだろう。陽子および中性子の個数の合計を「質量数」と呼ぶ。
原子核を構成しているこれらの粒子を、特に陽子同士の場合、同符号の電荷によるクーロンの斥力にもかかわらず、こんな小さな空間につなぎとめておくにはものすごく大きなエネルギーが必要なはずである。これは「核力」と呼ばれ、「量子力学・E=mc2(質量とエネルギーの等価性)」によってしか説明できない。
陽子と電子の持つ電荷の大きさは、ともに、e=1.60×10-19[c]であり、これは、宇宙に存在する電荷の最小単位「電気素量」と呼ばれる。
電気的に「中性な(プラス・マイナスがつりあった)」原子では、陽子の個数と核外電子の個数は必ず等しい。核外電子の個数および配置によって元素の性質が「周期性」を持っていることから、陽子および中性原子の核外電子の個数を「原子番号」と呼ぶ。
核外電子のいくつかが欠落すると、原子核の電荷と核外電子の電荷に不釣合いが生じ、原子は全体として正に帯電する。逆に、他の原子から電子を受け取ると、原子は全体として負に帯電する。これらがそれぞれ「陽イオン・陰イオン」の状態を表している。原子が、電子を失いやすいか、受け取りやすいかは、その電子配置により大まかに決定される(電気陰性度)。
大きな質量を持ち、正に帯電した原子核のまわりに、小さな質量を持ち、負に帯電した電子が存在している。それらの間に作用する力は、異符号の電荷の間にはたらくクーロンの「引力」であろう。「ニュートン力学」の常識から考えると、一定の大きさの「向心力」を受ける物体は、等速円運動を行うことが知られている。原子核と電子の運動も、これによって説明できると、誰もが考えた(長岡半太郎モデル)。
ところがこのモデルには解決できない矛盾がいくつも含まれていた。まず、荷電粒子が運動すると、その周りの空間に磁場が生じ、磁場が変動すると今度が電場が発生する。もし、電子が原子核の周りを「回転運動」しているのなら、電子は電磁波を発生して速やかにそのエネルギーを失い、運動エネルギーを失えば、等速円運動の半径は次第に小さくなるから、やがて原子核に激突してとまってしまうはずだ。現実にこのようなことは起こっていない。
また、核外電子に外部からエネルギーを与え「励起」させると、大きなエネルギーを持った電子は、大きな軌道半径に移るが、やがて再びもとの半径(定常状態)に戻る。この際、軌道の差に当たるエネルギーが電磁波として放出されるが、観測されたエネルギーは整数に関連付けられた、飛び飛びの値(量子化された値)であった。これは電子の軌道がエネルギーの大きさによって、等速円運動から説明できるような、連続的な値をとることができるわけではなく、飛び飛びの(量子化された)値しかとれないことを意味している。
ニールス・ボーアは、「光は波動として振舞うこともあれば、粒子として振舞うこともある」というアインシュタインの「光量子説」、「物質である電子も、波動として振舞うことがある」というド・ブロイの「物質波」のアイディアから、電子の運動する等速円運動の軌道の長さが、定常波を作る条件を満たす軌道にのみ電子が存在可能だという、大胆な仮説を導入し、水素原子の核外電子の発するスペクトルを計算によってすべて言い当てた。
「光の波長の大きさの世界」、「光の速度に近い速度で運動する物質の世界」ではわれわれの常識で理解できる「力学」の諸法則は、当てはまらないように見える。電子の世界を支配するルールは、「量子力学」による「説明」を「受け入れる」以外に「理解」する方法がない。
「量子力学」に基づく電子配置のルールについて、一部分だけ説明する。
電子の軌道を、原子核に近い内側から順番に、「K殻」、「L殻」、「M殻」と名前をつける。これらに1から順に整数(主量子数n)を割り当てると、各軌道に収容できる電子の最大数は、2n2で表される。
すなわち、「K殻:2個」、「L殻:8個」、「M殻:18個」である。
ところがこれとは別に、最外殻電子は「8個で安定化する」という「オクテット則」と呼ばれる法則がある。これは、4対の「電子対」が電荷の反発力から互いに最も空間的に遠くに配置しようとすると、互いに約109°(cosθ=-1/3)の角度をなして、正四面体の形を取る。この地上でもっとも強固なダイアモンドの結晶も、生物の身体を構成する有機化合物の基本構造も、地殻の造岩鉱物の主成分である2酸化ケイ素も、みなこの形をしていることから、正四面体という立体構造の「安定性」こそが、「オクテット則」の「理由」であると思われる。
そもそも負の電荷を持った電子がどうして「対」をつくって安定化するのかもなぞである。電子は「スピン」と呼ばれる回転運動のようなものをしているらしく、荷電粒子が回転すれば、周りの空間に磁場が形成される。2個の電子が逆方向の「スピン」を行うことで、静電気的には反発力を持つものの、磁気的には引力を生じ、これが「電子対」安定化の理由だとされている。
|
(1)電子は内側の殻から埋まる。
(2)対を作らなくてもいい場合(最外殻が4個未満)は、なるべく離れて配置する。 (3)最外殻が4個を超えると、いずれかが対を作る(孤立電子対・非共有電子対)。 (4)各軌道に収容できる電子の最大数は、2n2、「K殻:2個」、「L殻:8個」、「M殻:18個」であるが、M殻より外側の場合、「8個」まで埋まると、外側の殻に入り始めることがある。 |
炭素、窒素、酸素の最外殻の電子配置を模式化すると、次のようになる。●が電子であり、○が「電子を受け入れることができる場所」を表している。炭素は4方向、窒素は3方向、酸素は2方向、電子を受け入れて、安定化することができる。
|
|
| |||||||||||||||||||||||||||||||||||||||||||||
主な遷移元素
|
右の電子配置の表で、11Naから18Arまでは、「M殻」に順次電子が埋まっていくが、19K,20Caでは、18個まで収容できるはずの「M殻」を8個にしたまま、より外側の「N殻」に、入り始めている。
21Scから29Cuまで、最外殻である「N殻」には、1個または2個、これといった法則性も見られず、ほとんどでたらめに配置して、今度は内側の「M殻」が埋まっていく。 |
|
|
元素の化学的性質に、決定的な影響を及ぼす「最外殻電子数」を同じにしたまま、内側の殻が埋まっていく状態を「遷移」状態と呼び、この区間にある元素を「遷移元素」と呼ぶことにした。
30Znからは、「M殻」は18個で「閉殻」となり、原則どおり、最外殻に電子が入り始める。このような遷移元素以外の元素を「典型元素」と呼ぶ。 |
|
| 「N殻」から「O殻」への移り変わりにも同様なことが生じる。37Rb,38Srは、32個収容できるはずの「N殻」を8個のままにして、「O殻」に入り始める。39Yから47Agは、最外殻を1個または2個、ときには0個にしたまま、「N殻」を埋めていく「遷移元素」である。 |
|
| 原子核 | 核外 | ||
| 陽子(p+) | 中性子(n) | 電子(e-) | |
| 電荷 | +e | 0 | -e |
| 質量比 | 1850 | 1850 | 1 |
原子核は、正の電荷を持った陽子と電荷を持たない中性子からできている。これらの質量はほぼ等しく、核外電子の約1850倍である。したがって、原子の質量はそのほとんどが、原子核に集中しているといってよく、また、陽子および中性子の「個数」の整数倍に近い値になるだろう。陽子および中性子の個数の合計を「質量数」と呼ぶ。
原子1個の質量はきわめて小さいから、これを実用的な質量の単位「グラム」と関連をつける方法が考案された。すなわち、地上のどこにでも存在する、陽子6個(原子番号6番)、中性子6個、質量数12の炭素、12C が、実際に「いくつ集まれば」本当に12グラムになるのか、を考えた。
これが「アボガドロ数」であり、6.02×1023個の粒子の集団のことを、原子、分子、イオンその他原子団にかかわらず、すべて「モル」という単位で表示することにした。「原子量」とは、原子1モルの質量、すなわちアボガドロ数個の原子の質量をグラム単位で表示したものである。「原子量」には通常単位をつけないが、しいて言えばその単位は[g/mol]である。こうすることで、1モルの粒子の集団の質量は、その粒子の持つ「原子量」の和で表されることになる。
「共有結合(非金属元素同士の結合様式)」でできている「分子」については、構成元素の「原子量」の和を「分子量」と呼ぶ。
「金属結合(金属元素同士の結合様式)」性の物質、すなわち金属では、「分子」という実体がないので、「原子量」をそのまま用いる。
「イオン結合(金属元素と非金属元素の結合様式)」性の物質にも、「分子」という実体はなく、その化学式は、構成するイオンの個数の比を表すに過ぎないが、その「式」を基準として、構成元素の「原子量」の和を計算したものを「式量」と呼ぶ。
HCl=1+35.5=36.5
Ag=108
NaCl=23+35.5=58.5
周期表上の「原子量」の値が整数値にならず、端数を生じているのは、主に、天然に存在する同位体(原子番号が同じで、質量数、すなわち中性子の数が異なる元素)の存在比率が考慮されていることによる。
周期表の見方・化学結合、など
- 電子の「殻」の収容できる最大数が 2n2 で表されること
- 元素の化学的性質は、「最外殻電子」の個数によって特徴付けられること
この性質をわかりやすく表に並べたものが「周期表」である。
- 周期表の「左・下」側の「金属元素」は、「左」に行くほど「最外殻電子数」が少なく、「下」に行くほど最外殻電子と原子核の距離が大きいから、電子を失って、陽イオンになりやすい。これを「陽性」である、という。
- 周期表の「右・上」側の「非金属元素」は、「右」に行くほど「最外殻電子数」が安定な「閉殻構造」に近づき、「上」に行くほど最外殻電子と原子核の距離が小さいから、電子を受け取って、陰イオンになりやすい。これを「陰性」である、という。
- 金属と非金属の境界あたりの金属側に位置している「両性元素」(Al,Zn,Sn,Pb)は、これらの中間的な性質を持っている。
- アルカリ金属(第1族のうち、非金属である水素を除いたもの)・・・(Na,Kなど)
- アルカリ土類金属(第2族のうち、Caより原子番号が大きいもの)・・・(Ca,Baなど)
- 遷移元素(第3族~第11族、すべて金属元素)・・・(Fe,Cu,Ag,Cr,Mnなど)
- 両性元素(金属/非金属の境界付近に分布、すべて金属元素)・・・(Al,Zn,Sn,Pb)
- 非金属元素では、炭素(C)、窒素(N)、酸素(O)、ケイ素(Si)、リン(P)、硫黄(P)
ハロゲン(第17族)・・・(F,Cl,Br,I)
- 「第一イオン化エネルギー」は最外殻電子1個を奪って、1価の陽イオンにするために外部から加えなければならないエネルギー。「陽イオンになりにくい」度合いを表す。周期表の右上ほど大きい。同一周期では希ガスが最大になる。最外殻が「閉殻」できわめて安定だからだ。
- 「電子親和力」は、電子を1個受け取って1価の陰イオンになるときに放出するエネルギー。「陰イオンになりやすい」度合いを表す。周期表の右上ほど大きい。これも、周期表の右上ほど大きい。ただし、希ガスは含まない。最外殻が「閉殻」で安定だから、電子を放出することも受け取ることもない。したがって同一周期では「ハロゲン」が最大。
- 「電気陰性度」は、「第一イオン化エネルギー」と「電子親和力」の平均的な値。これも希ガスは含まない。
- 共有結合:非金属同士の結合。「電子対」の共有。
- イオン結合:非金属と金属の結合。電子の受け渡し、イオン間の静電引力。
- 金属結合:金属同士の結合。自由電子。
- 共有結合結晶:結晶のすべての部分が共有結合。ダイアモンド、二酸化ケイ素。「巨大分子」と呼ばれる。最も強力。
- イオン結晶:隣接する陽イオンと陰イオンが、静電引力により立体構造を作る。
- 金属結晶:金属陽イオンが互いの反発力のために、一定の距離を置いて並び、自由電子が互いにこれらを結合する。
- 分子結晶:共有結合によって形成された分子が、分子間力と呼ばれる(電荷の偏りに基づく)弱い力によって立体構造を作る。もっとも弱い。
- 共有結合結晶、イオン結晶、金属結晶では、その化学的性質を持った最小単位を、取り出すことができない。つまり「分子」が、ない。これらの物質を表す化学式は、構成元素の物質量比を最も簡単な整数比で表したものであり、「組成式」と呼ばれる。
「C(ダイアモンド・共有結合結晶)」、「Cu(金属結晶)」は、その構成元素がそれぞれ炭素、銅であることしか示していない。ダイアモンドや銅のかたまりの中の、「どこまでが」ひとつのダイアモンドや銅であるか、指し示すことができない。
「SiO2(共有結合結晶)」、「NaCl(イオン結晶)」は、それぞれ、ケイ素と酸素の物質量の比が1:2、ナトリウムと塩素の物質量の比が1:2、ということしか示していない。これらも同様に、二酸化珪素や塩化ナトリウムのかたまりの中の、「どこまでが」ひとつの二酸化ケイ素や塩化ナトリウムであるかを、指し示すことができない。
(共有結合結晶では、それでも「分子」と呼びたいがために、ダイヤモンドや二酸化ケイ素の結晶のことを「巨大分子」と呼んだりもする。)
- これに対して、分子結晶では、その化学的性質を持った最小単位を「分子」として取り出すことができる。このような物質(分子性物質)を表す化学式は、その分子を構成する原子の個数の数をそのまま表しており、「分子式」と呼ばれる。
「CO2」は、1個の二酸化炭素分子が、1個の炭素原子、2個の酸素原子でできていること示している。「Ar」は、アルゴン分子が単原子分子として存在していることを示している。
化学反応の量的関係
- 気体反応の場合:「アボガドロの法則」
常温・常圧(0°C、1気圧すなわち1013hPa)のもとでは、すべての気体はその種類にかかわらず、1モル当たり22.4lの体積を占める。
- 液体反応の場合・「濃度」の定義・質量パーセント濃度[%]と体積モル濃度[mol/l]
質量パーセント濃度[%]= 溶質[g] ×100 ――――― 溶液[g]
- gは「質量」の単位、molは「物質量」の単位。この二つを結びつけるのが、「モル質量(分子量・式量)」
- gは「質量」の単位、lは「体積」の単位。この二つを結びつけるのが、「密度」
「密度」は通常、g/cm3の単位で表される。1cm3=1ml=10-3l
体積モル濃度[mol/l]= 溶質[mol] ――――― 溶液[l]
化学反応には、大きく別けて次の二種類の反応がある。
- 「酸化数」の変化しない、(広い意味での)「酸・塩基反応」
- 「酸化数」の変化する、「酸化・還元反応」
- 「酸・塩基反応」のうちの代表的な「中和反応」では、
酸が放出した水素イオン(オキソニウムイオン)(H+)と、塩基が放出した水酸化物イオン(OH-)が1モルずつ結合し、水(H2O)1モルが発生することで完了する。
H2SO4 → 2H+ + SO42- ・・・(1)(酸)
NaOH → Na+ + OH- ・・・(2)(塩基)
「過不足なく」反応するには、(2)式を2倍してから(1)式と加えなければならない。
だから、「2価の酸・硫酸1モルと1価の塩基・水酸化ナトリウム2モルで中和する」ことになる。
H2SO4 + 2NaOH → 2H2O + Na2SO4 ・・・(1)+(2)×2
- 「酸化・還元反応」では、こんなに単純ではない。
還元剤が放出した電子(e-)を、酸化剤が受け取ることによって、酸化還元反応は「過不足なく」完了する。
何モルの電子がやり取りされるかは、それぞれの還元剤・酸化剤の性質によって異なる。反応の前後の「酸化数」の変化を調べてそれを明らかにしなければならない。
例えば、過マンガン酸カリウムという酸化剤とシュウ酸という還元剤の反応式は、次のようになる。
2KMnO4+3H2SO4+5H2C2O4→ 2MnSO4+K2SO4+8H2O+10CO2
- ここでは、もう少し簡単に「係数比較」ができてしまう反応式についてみてみよう。
化学反応の前後では、どの元素もその総量は「増えもせず、減りもせず」、変化していないこと、すなわち「質量保存則」を利用する。- [例1]炭酸水素ナトリウムの加熱分解(「酸化還元反応」ではない反応)
NaHCO3 →
Na2CO3 +
H2O +
CO2
炭酸水素ナトリウムを加熱すると、炭酸ナトリウム、水、二酸化炭素、の3つの物質が得られることは、知っていなければならない。
その上で、左辺と右辺の各構成元素についてその数が等しいという等式を立てる。
左辺の係数を1、右辺の係数をそれぞれ、x,y,zとすれば、
こうして、x = y = z =左辺 右辺 Na 1 2x C 1 x+z H 1 2y O 3 3x+y+2z が得られた。
- [例2]有機化合物の燃焼(「酸化還元反応」)
炭素、水素、酸素のみでできている有機化合物を完全燃焼させると、二酸化炭素と水のみになる。
このように、生成物の形がはっきりわかっているときは、酸化還元反応であっても、上のようなやり方を用いることが出来る。
エタノール(CH3-CH2-OH)の燃焼について考える。
C2H6O +
O2 →
CO2 +
H2O
係数を左から順に、1,x,y,zとすれば、
こうして、x = 3, y = 2, z = 3 が得られた。左辺 右辺 C 2 y H 6 2z O 1+2x 2y+z
熱化学
- 熱化学方程式
化学反応は、運動していた「反応側」の物質の粒子が衝突し、結合状態の変化を起こして「生成側」の物質になる過程であるから、熱(エネルギー)の変化をともなう。化学反応にともなう熱の出入りを「反応熱」と呼び、これを化学反応式の右辺(生成側)に書き加え、等号で結んだものを「熱化学方程式」という。
反応熱が正であるものを「発熱反応」、負であるものを「吸熱反応」という。
A+B = C+D + Q[kJ] 反応側 生成側 反応熱 - 生成熱
物質1molを、その成分元素の「単体」から生成するときにともなう反応熱を「生成熱」という。
- ヘスの法則
特定の「状態」にある物質の集まり(これを「系」という)の持っている「エネルギー」の総量は、他の「状態」からそこに至った「経路」によらず、一定であるはずだ。そうでないならば、より小さなエネルギーを供給して、逆反応を起こし、別の経路の正反応からより大きなエネルギーを取り出すことができてしまう。「無」から「有」を生み出せることになってしまう。
「反応熱」とは「反応側」が持っていたその状態固有のエネルギーと、「生成側」が持つに至ったその状態固有のエネルギーとの「差」を表している。「反応熱」は、「反応側」・「生成側」の「状態」を指定すれば、その「経路」によらず一定である。これを「ヘスの法則」といい、「エネルギー保存則」の表現の一種である。
[例]水素(気体)、炭素(固体・黒鉛)、メタン(気体)の燃焼熱(物質1molを完全燃焼するときに発生する熱量)から、メタンの生成熱を算出する。
水素(気体)
の燃焼熱H2(気)+(1/2)O2(気) = H2O(液) + 286[kJ] (1) 炭素(固体・黒鉛)
の燃焼熱C(黒鉛)+O2(気) = CO2(気) + 394[kJ] (2) メタン(気体)
の燃焼熱CH4(気)+2O2(気) = CO2(気)+2H2O(液) + 890[kJ] (3) メタン(気体)
の生成熱C(黒鉛)+2H2(気) = CH4(気) + Q[kJ] ------ ------ ------ ------ (2) C(黒鉛)+ O2(気)= CO2(気)+ 394[kJ] (1)×2 2H2(気)+ O2(気)= 2H2O(液)+ 2×286[kJ] (3)(左辺・右辺を
入れ替える)CO2(気)+2H2O(液)= CH4(気)+ 2O2(気)- 890[kJ] ------ ------ ------ ------ +) C(黒鉛)+2H2(気) = CH4(気) + 394+2×286-890=76[kJ]
酸・塩基反応
- 化学反応の分類
「酸化還元反応」以外の反応 「酸化還元反応」 電子の授受をともなわない反応
主に、「酸・塩基反応」電子の授受をともなう反応
- 酸・塩基とは何か?(アレニウスによる「酸・塩基」の定義)
- 酸:水溶液中で電離し、水素イオンH+(オキソニウムイオンH3O+)を、放出する物質。
塩酸:HCl→H++Cl-(HCl+H2O→H3O++Cl-)
硫酸:H2SO4→2H++SO42-(H2SO4+2H2O→2H3O++SO42-)
硝酸:HNO3→H++NO3-(HNO3+H2O→H3O++NO3-)
酢酸:CH3COOHH++CH3COO-(CH3COOH+H2O
H3O++CH3COO-)
硫化水素:H2SH++HS-
2H++S2-
二酸化炭素:CO2+H2OH++HCO3-
2H++CO32-
- 塩基:水溶液中で電離し、水酸化物イオンOH-を、放出する物質。
水酸化ナトリウム:NaOH→Na++OH-
水酸化カリウム:KOH→K++OH-
水酸化カルシウム:Ca(OH)2→Ca2++2OH-
水酸化バリウム:Ba(OH)2→Ba2++2OH-
アンモニア:NH3+H2ONH4++OH-
- 酸・塩基の定義の拡張(ブレンステッド・ローリーによる「酸・塩基」の定義)
水溶液中の反応以外にも拡張するために考案された。
NH3+HCl→NH4Cl- 「酸」とは「プロトンH+」を供与するものである。
- 「塩基」とは「プロトンH+」を受容するものである。
この定義に従えば、
HCl+H2O→H3O++Cl-
(HClはH2Oに「プロトン」を供与したから、「酸」である。H2OはHClから「プロトン」を受容したから、「塩基」である。)
H3O++Cl-→HCl+H2O (H3O+はCl-に「プロトン」を供与したから、「酸」である。Cl-はH3O+から「プロトン」を受容したから、「塩基」である。)
「酸」HClに対してCl-をその「共役塩基」、「塩基」H2Oに対してH3O+をその「共役酸」と呼ぶ。
NH3+H2O→NH4++OH-
(NH3はH2Oから「プロトン」を受容したから、「塩基」である。H2OはNH3に「プロトン」を供与したから、「酸」である。)
NH4++OH-→NH3+H2O
(OH-はNH4+から「プロトン」を受容したから、「塩基」である。NH4+はOH-に「プロトン」を供与したから、「酸」である。)
「塩基」NH3に対してNH4+をその「共役酸」、「酸」H2Oに対してOH-をその「共役塩基」と呼ぶ。
- なぜ、水素イオンや水酸化物イオンが放出されるのか?(「塩基」と「オキソ酸」の関係)
周期表は、左上側の「非金属元素」のエリアと、右下側の「金属元素」のエリアに大きく2分される。
左下に向かうほど、「陽性」が強い。これは、左側ほど最外殻電子の数が少なく、下側ほど最外殻電子と原子核の距離が長いから、最外殻電子1個を失い「陽イオン」になりやすいことを意味する。
右上に向かうほど(希ガス元素は除いて)、「陰性」が強い。これは、右側ほど最外殻電子の数が「閉殻」と呼ばれる安定個数に近く、上側ほど最外殻電子の殻と原子核の距離が短いから、外部の電子をひきつける力が大きいことを意味する。
ここで、X-O-Hという構造の物質を考える。Xのところに、ナトリウム(Na)、カリウム(K)などの「陽性」元素が入った場合、これらはそれぞれ、水酸化ナトリウム(NaOH)、水酸化カリウム(KOH)という「塩基」であるし、硫黄(S)、窒素(N)などの「陰性」元素が入ると、硫酸(H2SO4)、硝酸(HNO3)などの「酸(オキソ酸)」の構造の一部を表すことになる。
中央の酸素(O)は、すべての元素の中で、フッ素(F)についで2番目に「陰性」が強い元素であり、これに対して右側の水素は、非金属元素の中ではかなり「陰性」が弱い。非金属元素(陰性元素)同士の結合であるO-H間は、どちらも電子を引き寄せる傾向をもっているから、両者の間で「電子対」を共有する、という「共有結合」という形式を取る。
しかし、酸素と水素とでは「陰性」の度合いが違うから、間にある「共有電子対(●○)」は、より陰性の強い酸素側に引き寄せられている。
ここで「X」の代わりに「Na」が入ったとしよう。ナトリウムは陽性の強い元素であるから、電子を放出しやすく、酸素はこれ(□)を受け取って安定化できるから、O-H間の共有電子対をそれほど大きく引き寄せなくてもよいことになる。こうして、この物質はNa+とOH-に「電離」する。
一方、「X」の代わりに「S」が入ったとしよう。硫黄は酸素ほどではないがかなり陰性の強い元素であるから、電子を引き寄せる性質を持っており、S-O間の共有電子対(△●)は、どちらからも引き寄せられ、酸素側は、こちらからは十分な電子の密度を得られないから、O-H側の共有結合を、より強く引き寄せる。こうして水素側は、その核外電子を失って水素イオン(H+)となって離れていく。(水溶液中には水分子(H2O)がたくさんあるから、水分子のうち、負に帯電した酸素側に「配位結合」し、「オキソニウムイオン(H3O+)」を作って離れていく。)
- 酸・塩基の強さ
水溶液中で電離して水素イオン(H+)を放出するものが「酸」、水酸化物イオン(OH-)を放出するものが「塩基」であるから、酸・塩基の強さは、いかに多くの水素イオンや水酸化物イオンを放出することができるか?によって決まる。
はじめに水に溶かした「酸」または「塩基」の量に対する、水溶液中で電離しているものの割合を「電離度」と呼び、αで表す。αは当然、0から1の間の数値になる。電離度は、温度や濃度によって変わる。
一般に濃度が低いほど電離度は大きくなる。これは次のように説明できる。電離とは、
HCl→H++Cl-
のように、左辺から右辺に反応が進行すると、全体の粒子数が増加する反応である。一定量の液体中にごくわずかしか溶質の粒子が存在していなかったら、粒子数が増えても一つ一つの粒子が占めることのできる空間は十分にあるから、まだ右向きの反応は進むだろう。
しかし、液体中にすでに多くの溶質粒子が存在しているならば、これ以上粒子数が増えて、一つ一つの粒子の占める空間が小さくなるのは「安定」なことではない。右向きの反応の進行は抑えられるだろう。
こうして、まず「強い」酸・塩基とは、薄い酸・塩基であることがわかった。
では、どのような酸が強い酸か?
分子内に酸素(O:oxygen)を含む酸を「オキソ酸」と呼ぶが、オキソ酸の場合、上で述べたように、H-O-の隣に位置する陰性元素が、硫黄(S)、窒素(N)、塩素(Cl)など、陰性の強いものであると、水素イオンの放出がより容易になるだろう。また、それらの陰性元素に、さらにいくつかの酸素という陰性元素がつながっていると、そちら側からも電子対が引き寄せられるから、末端の水素は、より電離しやすくなる。同じ元素からできたオキソ酸では、一般に酸素数が多いほど、電離度が高く、強い酸である。
強酸 弱酸 H2SO4 硫酸 H2SO3 亜硫酸 HNO3 硝酸 HNO2 亜硝酸 HClO4 過塩素酸 HClO2 亜塩素酸 HClO3 塩素酸 HClO 次亜塩素酸
オキソ酸以外の酸には、ハロゲン化水素(HF,HCl,HBr,HI)、や硫化水素(H2S)がある。Hと直結している非金属元素の陰性の度合いによって、電子対の引き寄せられ方が変わり、水素イオンの電離のしやすさが変わってくるはずだ。しかし、ハロゲン化水素の場合、陰性の強さとは逆にHF<HCl<HBr<HIの順に電離度が高くなり、フッ化水素(HF)のみが弱酸で、他の塩化水素(HCl)、臭化水素(HBr)、ヨウ化水素(HI)は、強酸に分類される。これは、ハロゲン原子の大きさが、周期表の下に行くほど大きく、水素との距離が長くなるため、電離しやすくなるのだと説明されている。
特にフッ化水素(HF)は、フッ素が酸素よりも強力な、最強の陰性元素であるため、隣接するフッ化水素分子の水素側との間にかなり強い「水素結合」を形成し、これによって電離が妨げられるのだといわれている。
硫化水素(H2S)は弱酸である。
ハロゲン化水素の酸の強さ(電離度の大きさ) HF < HCl < HBr < HI
有機化学に登場する酸、カルボン酸(R-COOH)、フェノール(C6H5-OH)はいずれも弱酸で、その電離度の順位は、
フェノール<二酸化炭素(CO2)<カルボン酸<(強酸)
である。
また、アルコール(R-OH)は、同じく水酸基(-OH)を持っているのに酸ではない。
有機酸とアルコール アルコール
(酸ではない)フェノール
(弱酸)カルボン酸
(弱酸)
エタノール
フェノール
酢酸
この場合も、水素(H)の直結している酸素(O)に結合しているのはいずれも炭素(C)であるが、それがアルキル基(CH3-・・・-CH2-,アルコール)であるか、フェニル基(ベンゼン環、C6H5-,フェノール)であるか、カルボニル基(-CO-,カルボン酸)であるかによって、C-O間の共有電子対の引きつけ方に差があるからだろう。
次に、塩基。どのような塩基が強い塩基か?
水酸化物イオンが電離するためには、O-HのO側に電子を容易に放出しやすい陽性元素がいなければならない。一般に金属元素は陽性であるから、金属の水酸化物は、塩基である(塩基性水酸化物)。ところが、アルカリ金属(Na,Kなど)、アルカリ土類金属(Ca,Baなど)以外の金属の水酸化物は、水にほとんど溶けない。
したがって、水溶液中で電離し、大量の水酸化物イオンを放出できる強塩基は、アルカリ金属、アルカリ土類金属の水酸化物に限られることになる。
強塩基 アルカリ金属の水酸化物 NaOH(水酸化ナトリウム),KOH(水酸化カリウム) アルカリ土類金属の水酸化物 Ca(OH)2(水酸化ナトリウム),Ba(OH)2(水酸化カリウム)
金属水酸化物以外の塩基には、アンモニアがあり、これは弱塩基である。
NH3+H2ONH4++OH-
主な強酸・弱酸、強塩基・弱塩基 強酸 強塩基 HCl 塩酸
H2SO4 硫酸
HNO3 硝酸NaOH 水酸化ナトリウム
水酸化カリウムKOH
Ca(OH)2 水酸化カルシウム
Ba(OH)2 水酸化バリウム弱酸 弱塩基 CH3COOH 酢酸
CO2 二酸化炭素NH3アンモニア
なお、強酸・強塩基の電離度は、通常α=1である。つまり、水溶液中では、すべてが電離しており、例えばHClという塩化水素の「分子」、NaOHという「イオン対」は一つも存在しない。
これに対して、弱酸・弱塩基の電離度は、通常の温度、濃度の条件の下では、α=0.01程度であることが多い。これは、例えば、100個の酢酸分子のうち、1個のみが電離し、99個は水溶液中でも酢酸分子として存在していることを意味している。
- 酸性・塩基性(アルカリ性)の指標(pH)
あらゆる水溶液中の「水素イオン濃度」[H+](mol/l)と「水酸化物イオン濃度」[OH-](mol/l)の積は一定で、10-14であることが知られている(水のイオン積)。
[H+]・[OH-]=10-14
水素イオン濃度と水酸化物イオン濃度が等しい状態が「中性」であり、このとき、
[H+]=[OH-]=10-7(mol/l)
であることから、水素イオン濃度の指数の絶対値を液性の指標として、「水素イオン指数(pH)」とした。中性が7であり、これよりpHの値が小さいとき「酸性」、大きいとき「塩基性」となる。
pH=-log10[H+]
- 0.1(mol/l)の塩酸HClのpHは、
電離度が1であるとすると、溶液中の水素イオン濃度も0.1(mol/l)であるから、
pH=-log10(0.1)=1
- 0.1(mol/l)の水酸化バリウム水溶液Ba(OH)2のpHは、
電離度が1であるとすると、溶液中の水酸化物イオン濃度は0.2(mol/l)であるから、
[H+]=10-14/[OH-]=10-14/0.2
pH=-log10(10-14/0.2)=13+log10213.3
- 弱酸・弱塩基のpH
0.1(mol/l)の酢酸のpHを求める。電離度αをα=0.01とすれば、「電離平衡」に達した状態の水素イオン濃度はcαであるから、
[H+]=cα=0.1×0.01=10-3
pH=-log10[H+]=-log10(cα)=-log10(10-3)=3CH3COOH H+ + CH3COO- 電離前 c 0 0 電離 cα cα cα ------------ ------------ ------------ ------------ 電離後 c(1-α) cα cα
- 中和反応
水溶液中で水素イオンと水酸化物イオンから水が生成する反応
H++OH-→H2O (H3O++OH-→2H2O)
- 中和反応の「等量関係」と、「酸・塩基の強さ」
上の式から明らかなように、中和は、1個の水素イオン(または、オキソニウムイオン)と1個の水酸化物イオンが、したがって、1モルの水素イオン(または、オキソニウムイオン)ならば、1モルの水酸化物イオンと結合する反応である。
塩酸と水酸化ナトリウムは1モルずつで中和する。
HCl+NaOH→NaCl+H2O
塩酸と水酸化ナトリウムが、それぞれ1モルあたり1モルずつの水素イオン(オキソニウムイオン)、水酸化物イオンを放出するからである。
HCl→H++Cl-(HCl+H2O→H3O++Cl-)
NaOH→Na++OH-
硫酸と水酸化ナトリウムは1:2のモル比で中和する。
H2SO4+2NaOH→Na2SO4+2H2O
硫酸は1モルあたり2モルの水素イオン(オキソニウムイオン)、水酸化ナトリウムは1モルあたり1モルの水酸化物イオンを放出するからである。
H2SO4→2H++SO42- (H2SO4+2H2O→2H3O++SO42-)
NaOH→Na++OH-
1モルの酸・塩基が水溶液中で放出する水素イオン・水酸化物イオンのモル数を酸・塩基の「価数」という。塩酸は1価の酸、水酸化ナトリウムは1価の塩基、硫酸は2価の酸である。
価数 酸 塩基 1価 塩酸:HCl
硝酸:HNO3
酢酸:CH3COOH水酸化ナトリウム:NaOH
水酸化カリウム:KOH
アンモニア:NH32価 硫酸:H2SO4
硫化水素:H2S
二酸化炭素:CO2水酸化カルシウム:Ca(OH)2
水酸化バリウム:Ba(OH)2
ところで、「強い酸」・「強い塩基」は「弱い酸」・「弱い塩基」より電離度が高く、水溶液中でより多くの水素イオン、水酸化物イオンを放出するはずである。
ならば、「強い酸」と「弱い塩基」で中和を行った場合、より多くの「弱い塩基」が必要なのだろうか?これは誤りで、中和反応の等量関係には、酸・塩基の「強さ」は無関係である。
強酸である塩酸と、弱塩基であるアンモニアを例にとって、説明する。
等しい濃度の塩酸水溶液とアンモニア水を同じ量用意する。例えば1[mol/l]の塩酸とアンモニア水を1[l]ずつ用意したとすると、未電離の状態(実際にはそんな状態はありえないのだが、水に溶かす前の気体の塩化水素とアンモニアを考えれば、・・)の、それぞれ塩酸、アンモニアの「分子」はそれぞれ1[mol]ずつ、すなわち6.02×1023個ずつ存在しているはずだが、話を簡単にするために、仮に塩酸、アンモニア分子がちょうど100個ずつ存在していた、と仮定しよう。
塩酸は「強酸」であるから、電離度α=1、すなわち100個中100個がすべて電離する。
HCl → H+ + Cl- 電離前 100 0 0 電離 100 100 100 ――― ―― ― ―― ― ―― 電離後 0 100 100
これに対して、アンモニアは「弱塩基」であり、この濃度のもとでは電離度α=0.01、すなわち100個中1個のみ電離している、と仮定しよう。
NH3+H2O NH4+ + OH- 電離前 100 0 0 電離 1 1 1 ――― ―――― ― ―― ― ―― 電離後 99 1 1
こうして、それぞれの溶液中には、水素イオン(H+)100個、水酸化物イオン(OH-)1個が存在していることになり、
H++OH-→H2O・・・(1)
で、過不足なく中和するには、混合するアンモニア水の量の塩酸の100倍でなければならないように見える。
何が間違っているのだろうか?
アンモニアの電離式、
NH3+H2ONH4++OH-・・・(2)
の「」は、この反応が、まわりの環境によっては、右にも左にも進行することができるという仮の安定状態で止まっていることを示している(これを「電離平衡」という)。現在の濃度の条件では、アンモニア分子と水酸化物イオンが99:1の比で存在することが安定であるから、こうなっている。環境が変われば、右か左に反応が進行することもありうる。
これらの溶液を全量混ぜ合わせると、まず、塩酸の電離で生じた100個の水素イオンのうちの1個と、アンモニアの電離で生じた1個の水酸化物イオンが出会って、(1)の反応により「消えてなくなる」。これによって(2)の「平衡」はどう変わるだろうか?アンモニア分子およそ99個と、水酸化物イオン1個の割合で「安定化」していたのだ。水酸化物イオンが「なくなって」しまえば、その「安定化」の条件が崩れ、新たな安定を生み出すように反応が進行する。つまり、99個のうち1個が電離して、アンモニア分子98個:水酸化物イオン1個で、安定する。
ところが、混合溶液中には、水素イオンがまだ99個も存在しているのだから、(2)が右に進行することによって生み出された水酸化物イオンは、次々に(1)の反応によって「消費」され、そのため(2)がまた右に進行し、・・・・これらの繰り返しが、実際には目にもとまらぬ速さでほぼ、「同時」に進行して、100個目の水素イオンと100個目の水酸化物イオンが(1)によって「消滅」するまで続く。
こうして、1価の酸である塩酸と1価の塩基であるアンモニアは、その「酸・塩基」としての「強さ」にかかわらず、等しいモル数で中和する。
酸・塩基の『強さ』 「酸・塩基」の『強さ』は電離度αで決まる。 - α
1 であるものを「強酸・強塩基」と呼ぶ。
- α<<1 であるものを「弱酸・弱塩基」と呼ぶ。
中和反応の等量関係 中和反応の本質は、
H++OH-→H2O
であるから、1モルの水素イオンと1モルの水酸化物イオンで、過不足なく中和が完了する。
これは、「酸・塩基」の『強さ』には無関係である。
- 中和完了後の溶液の液性と、「酸・塩基の強さ」(「塩の加水分解」)
では、「酸・塩基」の「強さ」は、中和反応に何の関係もないのだろうか?そうではなく、中和完了後の溶液の液性(「酸性」か「塩基性」か?)に影響を及ぼすことになる。
この問題を考えるために、一見無関係なようであるが、「塩の加水分解」について、先に説明する。
「塩」とは、2種類以上の「イオン」からなる物質で、固体では、「イオン結晶」という形をとるが、水溶液中では、「沈殿」する場合を除き、すべて電離して、イオンの状態で存在する。
酸と塩基が中和反応をする際、中和完了後の水溶液中には、酸に由来する陰イオンと、塩基に由来する陽イオンが存在する。多くの「塩」は、実際にそれをどのように生成したかには関係なく、ある酸とある塩基の中和反応の結果できあがったものだと「解釈」することができるだろう。
例えば、「塩化アンモニウム(NH4Cl)は、塩酸とアンモニアの中和の結果生じた塩だ」というように。
とすれば、この観点から、「酸・塩基」の「強さ」によって、「塩」は4種類に分類できる。これらの塩を水に溶かした際、その水溶液は酸性を示すか、塩基性を示すか?これが「塩の加水分解」と呼ばれる問題である。
- 強酸・強塩基塩(例えば、NaCl)
塩化ナトリウム(NaCl)は、水に溶けやすく、水溶液中で完全に電離する。
NaCl→Na++Cl-
ここで、塩酸は強酸であるから、次の電離式は、大きく「右」に偏っており、塩化物イオンが、水溶液中に少量存在する水素イオンと出会っても、左向きの反応が進行して、塩酸分子が生じることはない。
HCl→H++Cl-
また、水酸化ナトリウムは強塩基であるから、次の電離式は、大きく「右」に偏っており、ナトリウムイオンが、水溶液中に少量存在する水酸化物イオンと出会っても、左向きの反応が進行して、水酸化ナトリウムというイオン対が生じることはない。
NaOH→Na++OH-
この結果、水素イオンも、水酸化物イオンも消費されず、水素イオン濃度、水酸化物イオン濃度は、溶媒である水と同じままであり、この水溶液は、中性を示す。
- 強酸・弱塩基塩(例えば、NH4Cl)
塩化アンモニウム(NH4Cl)は、水に溶けやすく、水溶液中で完全に電離する。
NH4Cl→NH4++Cl-
したがって、水溶液中には大量のアンモニウムイオン(NH4+)と塩化物イオン(Cl-)が存在することになる。
一方、塩酸は強酸であるから、次の電離式は、大きく「右」に偏っており、塩化物イオンが、水溶液中に少量存在する水素イオンと出会っても、左向きの反応が進行して、塩酸分子が生じることはない。
HCl→H++Cl-
ところが、アンモニアは弱塩基であるから、電離度が小さく、大量のアンモニウムイオンが存在する状態は「安定」とは言えず、水溶液中にわずかに存在する水酸化物イオンとただちに結合して(左向きの反応が進行して)、アンモニアを生成する。
NH3+H2ONH4++OH-
この結果、水素イオンは消費されず、水酸化物イオンは消費され、いかなる水溶液においても、水素イオン濃度と水酸化物イオン濃度は反比例の関係にあるから、水素イオン濃度のほうが水酸化物イオン濃度より大きくなることになり、この水溶液は、酸性を示す。
- 弱酸・強塩基塩(例えば、CH3COONa)
酢酸ナトリウム(CH3COONa)は、水に溶けやすく、水溶液中で完全に電離する。
CH3COONa→Na++CH3COO-
したがって、水溶液中には大量のナトリウムイオン(Na+)と酢酸イオン(CH3COO-)が存在することになる。
一方、酢酸は弱酸であるから、電離度が小さく、大量の酢酸イオンが存在する状態は「安定」とは言えず、水溶液中にわずかに存在する水素イオンとただちに結合して(左向きの反応が進行して)、酢酸を生成する。
CH3COOHH++CH3COO-
ところが、水酸化ナトリウムは強塩基であるから、次の電離式は、大きく「右」に偏っており、ナトリウムイオンが、水溶液中に少量存在する水酸化物イオンと出会っても、左向きの反応が進行して、水酸化ナトリウムというイオン対が生じることはない。
NaOH→Na++OH-
この結果、水酸化物イオンは消費されず、水素イオンは消費され、いかなる水溶液においても、水素イオン濃度と水酸化物イオン濃度は反比例の関係にあるから、水酸化物イオン濃度のほうが水素イオン濃度より大きくなることになり、この水溶液は、塩基性を示す。
- 弱酸・弱塩基塩(例えば、CH3COONH4)
酢酸アンモニウム(CH3COONH4)は、水に溶けやすく、水溶液中で完全に電離する。
CH3COONH4→NH4++CH3COO-
したがって、水溶液中には大量のアンモニウムイオン(NH4+)と酢酸イオン(CH3COO-)が存在することになる。
一方、酢酸は弱酸であるから、電離度が小さく、大量の酢酸イオンが存在する状態は「安定」とは言えず、水溶液中にわずかに存在する水素イオンとただちに結合して(左向きの反応が進行して)、酢酸を生成する。
CH3COOHH++CH3COO-
他方、アンモニアは弱塩基であるから、電離度が小さく、大量のアンモニウムイオンが存在する状態は「安定」とは言えず、水溶液中にわずかに存在する水酸化物イオンとただちに結合して(左向きの反応が進行して)、アンモニアを生成する。
NH3+H2ONH4++OH-
この結果、水酸化物イオンも、水素イオンも消費されることになるが、その割合は、それぞれの弱酸、弱塩基の電離度によることになり、この種の塩の水溶液の液性は、一概には決められないことになる。
塩の加水分解 強酸 弱酸 強塩基 強酸強塩基塩
中性弱酸強塩基塩
塩基性弱塩基 強酸弱塩基塩
酸性弱酸弱塩基塩
一概には決められない
このことから、「中和完了後の溶液の液性」について、同様のことが言える。- 「強酸」と「強塩基」で中和を行った場合、中和完了後の水溶液は、「強酸強塩基塩」の水溶液となっている。
したがって、中和完了点の液性は、「中性」である。
- 「強酸」と「弱塩基」で中和を行った場合、中和完了後の水溶液は、「強酸弱塩基塩」の水溶液となっている。
したがって、中和完了点の液性は、「酸性」である。
- 「弱酸」と「強塩基」で中和を行った場合、中和完了後の水溶液は、「弱酸強塩基塩」の水溶液となっている。
したがって、中和完了点の液性は、「塩基性」である。
- 「弱酸」と「弱塩基」で中和を行った場合、中和完了後の水溶液は、「弱酸弱塩基塩」の水溶液となっている。
したがって、中和完了点の液性については、酸塩基の種類によって異なり、一概には言えない。
下の図は、塩基に対して酸を滴下していった場合の「中和滴定曲線」を表している。
(3)が、強塩基に強酸、(2)が強塩基に弱酸、(1)が弱塩基に強酸を滴下した場合である。pHの変動が激しく、曲線が縦軸に平行になっている部分が、中和完了点であると推察される。
3の強塩基・強酸では、ほぼpH=7で中和しているのに対して、(2)の強塩基・弱酸では、塩基性側、(1)の弱塩基・強酸では酸性側、にそれぞれ中和点が偏っているのがわかる。(4)は弱塩基・弱酸の滴定であるが、明確な中和点がどこであるかすらわからない。
酸・塩基の「強さ」と、中和完了点の液性 強酸 弱酸 強塩基 中性 塩基性 弱塩基 酸性 一概には決められない
ところで、この話は、上で述べた「中和反応の等量関係」と、矛盾していないだろうか?
塩酸とアンモニアの中和において、強酸である塩酸が放出する大量の水素イオンが、弱塩基であるアンモニアの電離を促進し、「最後の1個の水素イオンと最後の1個の水酸化物イオン」が中和して「消滅する」まで、反応が進行する、と述べた。
それなのに、ここでは、強酸・弱塩基の滴定であるから、「水酸化物イオンより水素イオンがより多く存在している」から、酸性だと言っている。
これが「矛盾」に見えるのは、「ケタ数」の問題を度外視しているからだ。中和によって水素イオンと水酸化物イオンが「消滅」した、というのは、はじめが1[mol/l]ずつだったとして、1[mol/l]のケタ数としては、水素イオンも水酸化物イオンも、「消滅」したといえる、という意味だ。
「塩の加水分解」という過程が進行して(実際は、中和と同時に進行するのだが)、液性が「酸性」または「塩基性」に偏る、と言うとき、そこで問題にしているのは、pH=6~8、つまり、水素イオン濃度にして、10-6~10-8[mol/l]のケタ数である。
1に対して、10-6は、「無視」して差し支えない!だから、この2つの論点は、矛盾していない!
- 中和滴定とpH指示薬の変色域
- pH指示薬の変色域
- フェノールフタレイン:(無色)<pH8.0~9.8<(赤)
- メチルオレンジ:(赤)<pH3.1~4.4<(黄)
- 強酸・強塩基の滴定では、中和の終点が「中性」、pH=7付近である。 フェノールフタレイン、メチルオレンジ、どちらも使用可。上図(3)
- 強酸・弱塩基の滴定では、中和の終点が「酸性」側に偏る(pH<7)。 メチルオレンジのみ。上図(1)
- 弱酸・強塩基の滴定では、中和の終点が「塩基性」側に偏る(pH>7)。 フェノールフタレインのみ。上図(2)
酸・塩基の『強さ』 「酸・塩基」の『強さ』は電離度αで決まる。 - α
1 であるものを「強酸・強塩基」と呼ぶ。
- α<<1 であるものを「弱酸・弱塩基」と呼ぶ。
中和反応の等量関係 中和反応の本質は、 H++OH-→H2O であるから、1モルの水素イオンと1モルの水酸化物イオンで、過不足なく中和が完了する。
これは、「酸・塩基」の『強さ』には無関係である。中和完了後の水溶液の液性 中和完了後の水溶液の液性は、「酸・塩基」の『強さ』すなわち電離度に関係がある。 - 強酸-強塩基:中性
- 強酸-弱塩基:酸性
- 弱酸-強塩基:塩基性
酸化還元反応
- 化学反応の分類
「酸化還元反応」以外の反応 「酸化還元反応」 電子の授受をともなわない反応
主に、「酸・塩基反応」電子の授受をともなう反応
- 酸化還元反応
- 酸化還元の定義
酸素と結合する反応を「酸化」と呼び、酸化物から酸素が奪われる反応を「還元」と呼んだ。熱と光の放射をともなう激しい「酸化」を「燃焼」と呼ぶ。
2Cu+O2→2CuO 「銅」が「酸化」された
2CuO+C→2Cu+CO2 「酸化銅」が「還元」された
- 酸化還元の定義の拡張(1)
水素を奪われる反応を「酸化」と呼び、水素と結合する反応をも「還元」と呼ぶことにした。
2H2S+O2→2S+2H2O 「硫化水素」が「酸化」された
CuO+H2→Cu+H2O 「酸化銅」が「還元」された
- 酸化還元の定義の拡張(2)
酸化還元反応の本質は電子の授受にある。電子を失う反応を「酸化」呼び、電子を受け取る反応を「還元」と呼ぶ。
Cu+Cl2→CuCl2
---------------
Cu→Cu2++2e- 「銅」が電子を失って「銅の陽イオン」になった(「銅」が「酸化」された)
Cl2+2e-→2Cl- 「塩素分子」が電子を受け取って「塩素の陰イオン」になった(「塩素」が「還元」された)
「酸素」は、フッ素についで2番目に「陰性」が強い元素であるから、ほとんどの元素にとって、「酸素と結合する」ことは、「酸素」に電子を奪われることを意味する。
逆に、「水素」は、非金属元素の中ではかなり「陰性」が弱い元素であるから、多くの非金属元素にとって、「水素と結合する」ことは、「水素」から電子を受け取ることを意味する。
「酸化」される 「還元」される 電子を失う (e-は右辺) 電子を受け取る (e-は左辺) 酸化数が増加する 酸化数が減少する 「還元剤」 (「酸化剤」にe-を与える) 「酸化剤」 (「還元剤」からe-を受け取る) 「還元剤」⇒ e-の流れ ⇒「酸化剤」
- 酸化数
酸化還元反応は「電子のやりとり」を伴う反応である。だが、反応の前後で化合物の形が変わったとしても、その電子の状態を知ることは簡単ではない。原子のもつ電子の状態を、簡単な整数値で表現しようとしたものが『酸化数』である。
イオン結合(金属と非金属の結合)性の物質に関しては、金属側から非金属側に、「本当に」電子の移動が起こっていて、それがイオンの「価数」に反映している。NaClでは、ナトリウム原子が電子を1個失ってNa+という1価の陽イオンとなり、塩素原子が電子を1個受け取ってCl-という1価の陰イオンとなっている。だから、NaClというイオン結合性の物質の中のNaは「+1」、Clは「-1」という『酸化数』を持っている、ということにすればよい。
金属結合(金属と金属の結合)性の物質(金属単体)では、金属陽イオンが格子を作りその周りを「自由電子」が動き回っている、と説明される。金属単体全体としては、陽イオンと電子の電荷はつりあっている。誰も電子を受け取っても、失ってもいないから、『酸化数』は「0」とする。
共有結合(非金属と非金属の結合)では、どちらも陰性元素で、電子を引き寄せる性格が強いため、電子の受け渡しは完全には行われず、二つの原子核の間に「電子対」が「共有」されるという形態をとる。しかし、電子を引き寄せる性格、すなわち「陰性」は、元素によって異なり、より「陰性」の強い原子の側に「共有電子対」は引き寄せられている。
そこで、より「陰性」の強い元素に、「共有電子対」のすべてを割り当てたとしたときの各原子の「価数」を、『酸化数』とした。
塩化水素(塩酸)HClでは、HよりClが「陰性」が強い。1対の共有電子対の2個の電子をClに「割り当てる」と、Clは最外殻に8個の電子をもっていることになり、原子状態のときに比べて1個多いから、「-1」、Hは核外電子をすべて失ったことになるから、「+1」という『酸化数』をもつことになる。
共有結合であっても、同種の元素同士の結合では、「陰性」の差がないから、共有電子対はどちらにも「割り当て」られない。Cl2の場合、どちらも原子状態のときの7個ずつの電子をもっていることになるから、『酸化数』は「0」である。
イオン結合性物質 イオンの価数を『酸化数』とする 金属結合性物質(金属単体) 『酸化数』は「0」 共有結合性物質 より「陰性」の強い元素に共有電子対をすべて「割り当てた」としたときの価数を『酸化数』とする
ところで、Oはすべての元素の中でFについで陰性の強い元素であり、Hは非金属としては、かなり陰性の弱い元素である。
したがって、Oは(F以外の)どんな元素と結合しているときでも、2対の共有電子対をすべて自分の側に引き寄せているから『酸化数』「-2」、Hは、他のほとんどの非金属元素と結合しているとき、共有電子対をつねに相手方に与えてしまっているから、『酸化数』「+1」、ということになる。
こうして、以下の「酸化数算出ルール」が生まれる。
酸化数算出のルール(1) 単体の原子の酸化数は0 O2(0),S(0),Na(0) (2) 単原子イオンの酸化数は、その価数に等しい Na+(+1),Cl-(-1) (3) 化合物中の水素原子の酸化数を+1、
酸素原子の酸化数を-2と決めるH2O のHは+1、Oは-2
例外はH2O2で、この場合はOを-1とする(4) 電気的に中性な化合物の構成原子の
酸化数の総和は0であるH2SO4のSは、
(+1)×2+x+(-2)×4=0からx=+6となる(5) 多原子イオンの構成原子の
酸化数の総和は、そのイオンの価数に等しいMnO4-(過マンガン酸イオン)のMnは
x+(-2)×4=-1からx=+7
Cr2O72-(2クロム酸イオン)のCrは
2x+(-2)×7=-2からx=+6
- 酸化剤・還元剤
酸化還元反応は、電子の授受がその本質であるから、酸化と還元が単独で起こることはなく、反応側にある二つの物質が相互に相手を「酸化」または「還元」した、という関係に立っている。
相手を酸化する物質、すなわち自らは還元されている物質(酸化数が減少している物質)を「酸化剤」と呼び、
相手を還元する物質、すなわち自らは酸化されている物質(酸化数が増加している物質)を「還元剤」と呼ぶ。
- 酸化還元半反応式の作り方
1 酸化数の変化 「酸化剤」は酸化数が1減少するごとに、電子1モルを受け取る
「還元剤」は酸化数が1増加するごとに、電子1モルを放出する
『酸化数』はそれぞれの原子1個についての「電子状態」を表す数値だから、
酸化数の変化量は、原子の個数分掛け算する2 電子の授受 ------------------------------------------------------------------------------------------------ 3 電荷のつりあい まわりの溶液の液性によって、
水素イオンH+または水酸化物イオンOH-を加えて調節する4 物質のつりあい 水分子をいずれかの辺に加える
酸化還元反応の本質は、電子のやりとりにある。だから、「第2段階」までの半反応式が作れれば、酸化還元反応の量的関係を捉えるためには十分だ。以下では、「第2段階」までの半反応式を取り上げる。巻末に参考として「第4段階」までの式を示しておいた。- 酸化剤
- 硫酸酸性過マンガン酸カリウム
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
MnO4-(+7)→Mn2+(+2) - 電子の授受:マンガン原子1モル当たり酸化数が5減少しているから、5モルの電子を受け取ることになる。
MnO4-+5e-→Mn2+
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 硫酸酸性ニクロム酸カリウム
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
Cr2O72-(+6)→2Cr3+(+3) - 電子の授受:クロム原子1モル当たり酸化数が3減少しているから、2モルのクロム原子は対して6モルの電子を受け取ることになる。
Cr2O72-+6e-→2Cr3+
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 濃硫酸
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2SO4(+6)→SO2(+4) - 電子の授受:硫黄原子1モル当たり酸化数が2減少しているから、2モルの電子を受け取ることになる。
H2SO4+2e-→SO2
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 希硝酸
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
HNO3(+5)→NO(+2) - 電子の授受:窒素原子1モル当たり酸化数が3減少しているから、3モルの電子を受け取ることになる。
HNO3+3e-→NO
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 濃硝酸
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
HNO3(+5)→NO2(+4) - 電子の授受:窒素原子1モル当たり酸化数が1減少しているから、1モルの電子を受け取ることになる。
HNO3+e-→NO2
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 過酸化水素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2O2(-1)→2H2O(-2) - 電子の授受:酸素原子1モル当たり酸化数が1減少しているから、2モルの酸素原子に対して2モルの電子を受け取ることになる。
H2O2+2e-→2H2O
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 二酸化硫黄
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
SO2(+4)→S(0) - 電子の授受:硫黄原子1モル当たり酸化数が4減少しているから、4モルの電子を受け取ることになる。
SO2+4e-→S
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 塩素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
Cl2(0)→2Cl-(-1) - 電子の授受:塩素原子1モル当たり酸化数が1減少しているから、2モルの塩素原子に対して、2モルの電子を受け取ることになる。
Cl2+2e-→2Cl-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 硫酸酸性過マンガン酸カリウム
- 還元剤
- シュウ酸
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
(COOH)2→H2C2O4(+3)→2CO2(+4) - 電子の授受:炭素原子1モル当たり酸化数が1増加しているから、2モルの炭素原子あたり2モルの電子を放出することになる。
H2C2O4→2CO2+2e-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 塩化スズ(Ⅱ)
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
Sn2+(+2)→Sn4+(+4) - 電子の授受:スズイオン(Ⅱ)1モル当たり酸化数が2増加しているから、2モルの電子を放出することになる。
Sn2+→Sn4++2e-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 硫化水素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2S(-2)→S(0) - 電子の授受:硫黄原子1モル当たり酸化数が2増加しているから、2モルの電子を放出することになる。
H2S→S+2e-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 過酸化水素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2O2(-1)→O2(0) - 電子の授受:酸素原子1モル当たり酸化数が1増加しているから、2モルの酸素原子に対して2モルの電子を放出することになる。
H2O2→O2+2e-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 二酸化硫黄
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
SO2(+4)→SO42-(+6) - 電子の授受:硫黄原子1モル当たり酸化数が2増加しているから、2モルの電子を受け取ることになる。
SO2→SO42-+2e-
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- シュウ酸
- 酸化還元全反応式
酸化剤・還元剤の間で電子が「過不足なく」やりとりされるように、二つの「半反応式」の係数を調節する。
[例]硫酸酸性過マンガン酸カリウムとシュウ酸
MnO4-+5e- → Mn2+ (1) H2C2O4 → 2CO2+2e- (2) -------------- --------------- 2MnO4-+ 10e-+5H2C2O4→ 2Mn2++10CO2+ 10e-2×(1)+5×(2)
- 金属のイオン化傾向
金属元素が陽イオンになる反応は、電子を受け取る「酸化」反応である。金属単体の「酸化」されやすさ、すなわち「還元剤」としての強度を、順に並べたものを「イオン化列」と呼ぶ。(さまざまな物質の酸化剤・還元剤としての強度の指標である「標準電極電位」の大きさの順序を、主な金属元素と水素について並べたものである。)K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Pt Au アルカリ金属Na,K
アルカリ土類金属Ca
アルカリ土類以外の2族Mg両性元素 遷移元素 両性元素 遷移元素 水との反応 常温で反応
水素発生高温の水蒸気と反応
水素発生反応しない 2H2O+2e-→H2+2OH-
水が酸化剤としてはたらく酸との反応
希HCl,希H2SO4反応して、水素発生
2H++2e-→H2↑
水素イオンが酸化剤としてはたらく反応しない 酸化力のある酸との反応
濃硫酸H2SO4
希硝酸HNO3
濃硝酸HNO3反応して、気体発生
濃硫酸:SO42-+2e-+4H+→SO2+2H2O
希硝酸:NO3-+3e-+4H+→NO+2H2O
濃硝酸:NO3-+e-+2H+→NO2+H2O例外:「不動態」など * * ** (*)Al,Feは表面に酸化被膜を生じ、濃硝酸、濃硫酸との反応は進行しない(不動態)。
(**)PbCl2,PbSO4はともに難溶性の塩であるから、鉛と塩酸、希硫酸との反応において、これらが表面を覆って反応が進行しない。両性元素の単体
塩基とも反応○ ○ ○ ○ 水素発生(水が酸化剤としてはたらく)
2Al+2NaOH+6H2O→2Na++2[Al(OH)4]-+3H2
Zn+2NaOH+2H2O→2Na++[Zn(OH)4]2-+H2
イオン化傾向が極めて大きな金属は、水と反応して水素を発生する
水が『酸化剤』となっているイオン化傾向が水素より大きな金属は、希酸と反応して水素を発生する
水素イオンが『酸化剤』となっている両性元素の単体(Al,Zn,Sn,Pb)は、塩基とも反応して水素を発生する AuとPtを除くすべての金属は、酸化力のある酸(濃硫酸・希硝酸・濃硝酸)と反応してそれぞれ、二酸化硫黄・一酸化窒素・ニ酸化窒素の気体を発生する
[注]うすい強酸は電離度が高く、多くの水素イオンを放出する。希塩酸、希硫酸、希硝酸がその代表である。ところが希硝酸は「酸化力」があるから、希硝酸と、水素よりイオン化傾向が大きい金属を反応させたとき、水素が発生するのか、一酸化窒素が発生するのかは、反応条件によって変わってくるだろうから、「酸との反応」には希硝酸が除外されている。
また、「酸化力のある酸」は、水素よりイオン化傾向が大きい金属とも反応するが、このときも水素イオンが酸化剤となる反応が優先するのか、「酸化力のある酸」による反応が優先するのかが、明らかでないから問題にしない。
- 電池
イオン化傾向の異なる金属(より広くは、「標準電極電位」の異なる酸化剤・還元剤)を接続すれば「起電力」を取り出すことができる。これを「電池」という。
イオン化傾向が大きい、すなわち「還元剤」側は、負の電荷である電子を「放出する」ことになるから、「負極」と呼び、
イオン化傾向が小さい、すなわち「酸化剤」側は、負の電荷である電子を「受け取る」ことになるから、「正極」と呼ぶ。- ボルタ電池:(-)Zn|H2SO4aq|Cu(+)
負極:Zn→Zn2++2e-
正極:2H++2e-→H2
- 燃料電池(リン酸を用いるもの):(-)H2|H3PO4aq|O2(+)
燃料電池(水酸化カリウムを用いるもの):(-)H2|KOHaq|O2(+)
負極:H2→2H++2e-
正極:O2+4e-+2H2O→4OH-
- 鉛蓄電池(2次電池):(-)Pb|H2SO4aq|PbO2(+)
- 放電
それぞれの極での半反応式は、・負極 Pb → Pb2+ +2e- (0) (+2) ・正極 PbO2 +2e-+4H+ → Pb2+ +2H2O (+4) (+2)
全反応式は、
Pb+PbO2+4H+→2Pb++2H2O
Pb+PbO2+2H2SO4→2PbSO4+2H2O
放電が進行するにつれ、それぞれの電極が溶解し、難溶性の塩であるPbSO4が電極の表面に付着して電極反応が阻害され、かつ、硫酸の濃度が低下する、ことがわかる。 - 充電
外部の電源と接続して逆反応を起こすことにより、起電力を回復できる。
2PbSO4+2H2O→Pb+PbO2+2H2SO4
鉛蓄電池 2モルの電子が流れることで、 - 負極では、PbがPbSO4になり、
その質量は、SO42-の分(96g)だけ増加する。 - 正極では、PbO2がPbSO4になり、
その質量は、SO42-ひくO2の分(96-32=64g)だけ増加する。 - 電解液(希硫酸)は、その2モルが水になるから、濃度はうすくなる。
- 負極では、PbがPbSO4になり、
- 放電
- 電気分解
イオンを含んだ溶液に、外部の電池の起電力(酸化還元反応によるエネルギー)を加えることによって、強制的に酸化還元反応を生じさせる仕組み。
「それぞれの極で、何が『還元剤』、『酸化剤』になるか?」が問題である。
陽極:電池の「正極」と接続された極板 - 電池の「正極」は、「正の電荷」を放出する。
実際には、「電子」という「負の電荷」を受け取る。
酸化数が減少する還元反応が生じている。 - 「陽極」は電子を奪われる(酸化反応)
陰極:電池の「負極」と接続された極板 - 電池の「負極」は、「電子」という「負の電荷」を放出する。
酸化数が増加する酸化反応が生じている。 - 「陰極」は電子を供給される(還元反応)
- 陽極反応
- 電池の正極に向かって電子が出て行く。
- 陽極の極板は、電子が不足する。
- 何かが、電子を補わなければならない。
- 「酸化反応」が起こると、電子が放出される。電子を放出するのは「還元剤」である。
- 電極の金属が溶けて陽イオンとなるとき、その金属は「還元剤」として働いている。
電極が溶けるときは、電極の金属が「還元剤」となって、電子を供給する。
- 電極が銅の場合 Cu → Cu2+ + 2e-
(2モルの電子の移動で、1モルの銅が溶ける) - 電極が銀の場合 Ag → Ag+ + e-
(1モルの電子の移動で、1モルの銀が溶ける)
- 電極が銅の場合 Cu → Cu2+ + 2e-
- 電極が溶けないときは、電解液に含まれる何かが、「還元剤」とならなければならない。
酸素はフッ素を除くすべての元素より「陰性」が強い。「陰性」は、電子をひきつける力、すなわち「酸化力」である。
塩素は、酸素より「酸化力」が小さい。
O2+4e-+2H2O→4OH-・・・(1)
O2+4e-+4H+→2H2O・・・(1)'
Cl2+2e-→2Cl-・・・(2)
「酸素」が「酸化剤」として反応して「水」や「水酸化物イオン」になる反応((1)または(1)')の方が、「塩素」が「酸化剤」として反応して「塩化物イオン」になる反応((2))の方が、起こりにくい。
ということは、逆に、「水」や「水酸化物イオン」が「還元剤」として反応して「酸素」になる反応の方が、「塩化物イオン」が「酸化剤」として反応して「塩素」になる反応の方が、起こりやすい。
水溶液中に塩化物イオンがあるときは、これが「還元剤」となって、塩素が発生する。
2Cl- → Cl2 + 2e-
(2モルの電子の移動で1モルの塩素が発生する)
- 水溶液中に塩化物イオンがなければ、水または水酸化物イオンが、「還元剤」となって、酸素が発生する。
水溶液中に塩化物イオンがなければ、酸素が発生する。
- 中性・酸性溶液
2H2O → O2 + 4e- + 4H+
(4モルの電子の移動で1モルの酸素が発生する)
- 塩基性溶液
4OH- → O2 + 4e- + 2H2O
(4モルの電子の移動で1モルの酸素が発生する)
- 中性・酸性溶液
- 陰極反応
- 電池の負極から電子を供給される。
- 陰極の極板は、電子が過剰な状態になる。
- 何かが、電子を消費しなければならない。
- 「還元反応」が起こると、電子が消費される。電子を受け取るのは「酸化剤」である。
- ところで、「イオン化傾向」というのは、金属単体について「電子を放出して陽イオンになる傾向の強さ」を並べたものであった。
つまり、これは「還元力」の強さの順位のことだ。
【大】 ← イオン化傾向(「還元剤」としての力) → 【小】 イオン化傾向 K Ca Na Mg Al Zn Fe Ni Sn Pb H2 Cu Hg Ag Pt Au
Na → Na+ + e- ・・・(1)
H2 → 2H+ + 2e-・・・(2)
Ag → Ag+ + e- ・・・(3)
の3つを比較したときに、(1)>(2)>(3)の順に「起こりやすい」、
すなわち、それぞれの式の左辺の物質の「還元力」は(1)>(2)>(3)の順位である。
このことを裏から見れば、それぞれの式の右辺の「イオン」の「酸化力」は、この逆順、つまり、
Ag+ > H+ > Na+
と言える。水溶液中には「水」が必ずあるから、水素イオンまたはこれと酸化数の等しい水の単体が、かならず存在している。
だから、陰極反応で何が「酸化剤」になるかは、水溶液中に「水素よりイオン化傾向が小さい金属の陽イオンが存在するかどうか?」で決まる。
水溶液中に「水素よりイオン化傾向が小さい金属の陽イオンが存在する」ときは、これが「酸化剤」となって、その金属の単体が発生(析出)する。
- 銅イオンがある場合
Cu2+ + 2e- → Cu
(2モルの電子の移動で、1モルの銅が析出する) - 銀イオンがある場合
Ag+ + e- → Ag
(1モルの電子の移動で、1モルの銀が析出する)
水溶液中に「水素よりイオン化傾向が小さい金属の陽イオンが存在しない」ときは、水または水素イオンが、「酸化剤」となって、水素が発生する。
- 酸性溶液
2H+ + 2e- → H2
(2モルの電子の移動で1モルの水素が発生する)
- 中性・塩基性溶液
2H2O + 2e- → H2 + 2OH-
(2モルの電子の移動で1モルの水素が発生する)
- 銅イオンがある場合
- まとめ
[問題] 次の各場合について、電極反応を示し、9.65[A]の電流を10分間流したときに、電極が解ける場合はその質量[g]、発生する物質については、金属の場合はその質量[g]、気体の場合は標準状態におけるその体積[ml]で表せ。 [例]塩化ナトリウム水溶液(白金電極) 陽極反応 陰極反応 2Cl- → Cl2 + 2e-
流れた電子と発生した気体の物質量の比
2H2O + 2e- → H2 + 2OH-
流れた電子と発生した気体の物質量の比
[1]希塩酸(白金電極) 陽極反応 陰極反応 [2]希硫酸(白金電極) 陽極反応 陰極反応 [3]水酸化ナトリウム水溶液(白金電極) 陽極反応 陰極反応
[4]硫酸銅水溶液(白金電極) 陽極反応 陰極反応 [5]硫酸銅水溶液(銅電極) 陽極反応 陰極反応 [6]硝酸銀水溶液(白金電極) 陽極反応 陰極反応 [7]硝酸銀水溶液(銀電極) 陽極反応 陰極反応
- 電気分解の量的関係(電気分解に関するファラデーの法則)
電子1molの持つ電気量を1F(ファラデー)という。 1F=96500C(クーロン)
電流の単位は「アンペア」 [A=C/S]、 1秒間に流れた電気量を意味する。
酸化還元半反応式のe-の物質量(モル数)から、発生する気体、析出する金属の量を計算できる。
i[A]の電流を、t[s](秒)流したときに移動する電子のモル数
ただし、F=96500[c/mol]
- 酸化アルミニウムの融解塩電解
イオン化傾向がHより大きい金属は、水溶液の電気分解では、決して取り出すことができない。これらの金属については、そのイオンを含む塩を、水を加えずに高温で融解し、電気分解を行って取り出す。これを「融解塩電解」と呼ぶ。
アルミニウムは軽くて腐食に強く(酸化皮膜)、展性・延性に富み加工しやすい。
アルミニウムは地殻中に、酸素、ケイ素についで多量に存在するが、ほとんどが酸化物、ケイ酸塩の形をとっており、イオン化傾向が大きいため、単体を取り出す方法がなく、現代にいたるまであまり利用されていなかった。
アルミニウムの鉱石は「ボーキサイト」と呼ばれ、その主成分は酸化アルミニウムAl2O3(アルミナ)である。イオン化傾向の比較的高いアルミニウムが、濃硝酸などの強力な酸化剤にも溶けない(不動態)のは、酸化アルミニウムの皮膜が強力だからだ。
このことからもわかるように、アルミナを融解するのは困難であったが、「氷晶石(Na3AlF6)」に溶かし込むことが可能であることが発見され、これを用いた融解塩電解で大量生産が可能になった。しかし、融解塩電解は、大量の電力を消費するため、コストが大きい。アルミ製品のリサイクルがうまく機能しているのはこのためである。
陽極(炭素):3C+3O2-→3CO+6e-
陰極(炭素):2Al3++6e-→2Al
---------------------------------------------------------
全反応:Al2O3+3C→2Al+3CO
- [参考]酸化剤・還元剤の半反応式と酸化還元全反応式
- 酸化剤
- 硫酸酸性過マンガン酸カリウム
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
MnO4-(+7)→Mn2+(+2) - 電子の授受:マンガン原子1モル当たり酸化数が5減少しているから、5モルの電子を受け取ることになる。
MnO4-+5e-→Mn2+ - 電荷のつりあい:左辺の電荷の合計は-6、これに対して右辺は+2だから、左辺に+8の電荷が不足している。酸性状態で水素イオンH+が豊富に存在することから、これを左辺に加える。
MnO4-+5e-+8H+→Mn2+ - 物質のつりあい:左辺には右辺に比べて8モルの水素と4モルの酸素が過剰に存在している。そこで4モルの水を右辺に加える。
MnO4-+5e-+8H+→Mn2++4H2O
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 硫酸酸性2クロム酸カリウム
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
Cr2O72-(+6)→2Cr3+(+3) - 電子の授受:クロム原子1モル当たり酸化数が3減少しているから、2モルのクロム原子は対して6モルの電子を受け取ることになる。
Cr2O72-+6e-→2Cr3+ - 電荷のつりあい:左辺の電荷の合計は-8、これに対して右辺は+6だから、左辺に+14の電荷が不足している。酸性状態で水素イオンH+が豊富に存在することから、これを左辺に加える。
Cr2O72-+6e-+14H+→2Cr3+ - 物質のつりあい:左辺には右辺に比べて14モルの水素と7モルの酸素が過剰に存在している。そこで7モルの水を右辺に加える。
Cr2O72-+6e-+14H+→2Cr3++7H2O
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 濃硫酸
H2SO4+2e-+2H+→SO2+2H2O - 希硝酸
HNO3+3e-+3H+→NO+2H2O - 濃硝酸
HNO3-+e-+H+→NO2+H2O - 過酸化水素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2O2(-1)→2H2O(-2) - 電子の授受:酸素原子1モル当たり酸化数が1減少しているから、2モルの酸素原子に対して2モルの電子を受け取ることになる。
H2O2+2e-→2H2O - 電荷のつりあい:左辺の電荷の合計は-2、これに対して右辺は0だから、左辺に+2の電荷が不足している。
- 酸性状態で水素イオンH+が存在するときは、これを左辺に加える。
H2O2+2e-+2H+→2H2O - 中性・塩基性状態では状態では水素イオンH+が存在していないので、水酸化物イオンOH-を、右辺に加える。
H2O2+2e-→2H2O+2OH-
- 酸性状態で水素イオンH+が存在するときは、これを左辺に加える。
- 物質のつりあい
- 酸性状態:すでにつりあっている。
H2O2+2e-+2H+→2H2O - 中性・塩基性状態:右辺には左辺に比べて4モルの水素と2モルの酸素が過剰に存在している。そこで2モルの水を左辺に加える。
H2O2+2e-+2H2O→2H2O+2OH-
結局、以下のようになる。
H2O2+2e-→2OH-
- 酸性状態:すでにつりあっている。
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 二酸化硫黄
SO2+4e-+4H+→S+2H2O - オゾン
- 酸化数の変化(カッコ内は下線部の原子の酸化数):「酸化数」の定義上、単体は0であるから、オゾン分子から酸素分子への変化を「酸化数」によっては表現できない。
O3(0)→O2(0)
O3(0)→O2(0)+H2O(-2) - 電子の授受
O3+2e-→O2+H2O - 電荷のつりあい
O3+2e-+2H+→O2+H2O - 物質のつりあい:すでにつりあっている。
- 酸化数の変化(カッコ内は下線部の原子の酸化数):「酸化数」の定義上、単体は0であるから、オゾン分子から酸素分子への変化を「酸化数」によっては表現できない。
- 塩素
Cl2+2e-→2Cl-
- 硫酸酸性過マンガン酸カリウム
- 還元剤
- シュウ酸
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
(COOH)2→H2C2O4(+3)→2CO2(+4) - 電子の授受:炭素原子1モル当たり酸化数が1増加しているから、2モルの炭素原子あたり2モルの電子を放出することになる。
H2C2O4→2CO2+2e- - 電荷のつりあい:左辺の電荷の0、これに対して右辺は-2だから、右辺に+2の電荷が不足している。シュウ酸は酸であるから、水素イオンH+が存在するので、2モルを右辺に加える。
H2C2O4→2CO2+2e-+2H+ - 物質のつりあい:すでにつりあっている。
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 塩化スズ(Ⅱ)
Sn2+→Sn4++2e- - 硫化水素
H2S→S+2e-+2H+ - 過酸化水素
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
H2O2(-1)→O2(0) - 電子の授受:酸素原子1モル当たり酸化数が1増加しているから、2モルの酸素原子に対して2モルの電子を放出することになる。
H2O2→O2+2e- - 電荷のつりあい:左辺の電荷の合計は0、これに対して右辺は-2だから、右辺に+2の電荷が不足している。
- 中性・酸性状態では、水酸化物イオンOH-は存在しないから、水素イオンH+を右辺に加える。
H2O2→O2+2e-+2H+ - 塩基性状態では状態では水酸化物イオンOH-を、左辺に加える。
H2O2+2OH-→O2+2e-
- 中性・酸性状態では、水酸化物イオンOH-は存在しないから、水素イオンH+を右辺に加える。
- 物質のつりあい
- 中性・酸性状態:すでにつりあっている。
H2O2→O2+2e-+2H+ - 塩基性状態:左辺には右辺に比べて4モルの水素と2モルの酸素が過剰に存在している。そこで2モルの水を右辺に加える。
H2O2+2OH-→O2+2e-+2H2O
- 中性・酸性状態:すでにつりあっている。
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- 二酸化硫黄
SO2+2H2O→SO42-+2e-+4H+
(酸化剤としての「濃硫酸」の逆反応である)- 酸化数の変化(カッコ内は下線部の原子の酸化数)
SO2(+4)→SO42-(+6) - 電子の授受:硫黄原子1モル当たり酸化数が2増加しているから、2モルの電子を受け取ることになる。
SO2→SO42-+2e- - 電荷のつりあい:左辺の電荷の合計は0、これに対して右辺は-4だから、右辺に+4の電荷が不足している。水素イオンH+を右辺に加える。
SO2→SO42-+2e-+4H+ - 物質のつりあい:右辺には左辺に比べて4モルの水素と2モルの酸素が過剰に存在している。そこで2モルの水を左辺に加える。
SO2+2H2O→SO42-+2e-+4H+
- 酸化数の変化(カッコ内は下線部の原子の酸化数)
- シュウ酸
- 酸化還元全反応式
酸化剤・還元剤の間で電子が「過不足なく」やりとりされるように、二つの「半反応式」の係数を調節する。
酸化還元反応には直接関与しない(酸化数変化のない)イオンを両辺に加える。
[例]硫酸酸性過マンガン酸カリウムとシュウ酸
MnO4-+5e-+8H+ → Mn2++4H2O (1) H2C2O4 → 2CO2+2e-+2H+ (2) -------------- --------------- 2MnO4-+ 10e-+16H+
+5H2C2O4→ 2Mn2++8H2O
+10CO2+10e-+10H+2×(1)+5×(2) -------------- --------------- 2MnO4-+6H++5H2C2O4 → 2Mn2++8H2O+10CO2 両辺に、2K+,3SO42-を加える 2KMnO4+3H2SO4+5H2C2O4 → 2MnSO4+K2SO4+8H2O+10CO2
無機化合物・各論/周期表上の各グループとその性質
- アルカリ金属(Na,K)・アルカリ土類金属(Ca,Ba)
アルカリ金属
アルカリ土類金属
- 水と激しく反応して水素を発生し(酸化還元反応)、塩基性(アルカリ)の溶液となることから、この名前がある。
Ca + 2H2O → H2 + Ca(OH)2
- ナトリウムと、水・アルコール・フェノールとの反応
2Na + 2H2O → H2 + 2NaOH
2Na + 2CH3-CH2-OH → H2 + 2CH3-CH2-ONa
2Na + 2→ H2 + 2
- 遷移元素

- 複数の酸化数を取るものが多い。
最外殻だけでなく、内側の軌道の電子(d軌道電子)も脱落してイオンを作るためである。クロムCr +3価:Cr3+
+6価:K2CrO4(クロム酸カリウム)
+6価:K2Cr2O7(二クロム酸カリウム)マンガンMn +2価:Mn2+
+4価:MnO2(二酸化マンガン)
+7価:KMnO4(過マンガン酸カリウム)鉄Fe +2価:Fe(OH)2(水酸化鉄(Ⅱ))
+3価:Fe(OH)3(水酸化鉄(Ⅲ))
- 有色のイオンが多い
クロムCr Cr3+:緑色
CrO42-(クロム酸イオン):黄色
Cr2O72-(二クロム酸イオン):赤橙色マンガンMn Mn2+:淡桃色
MnO4-(過マンガン酸イオン):赤紫色鉄Fe Fe2+:淡緑色
Fe3+:黄褐色銅Cu Cu2+:青色
[Cu(NH3)4]2+(テトラアンミン銅(Ⅱ)イオン):深青色銀Ag Ag+:無色
[Ag(NH3)2]+(ジアンミン銀(Ⅰ)イオン):無色
- 両性元素(Al,Zn,Pb,Sn)
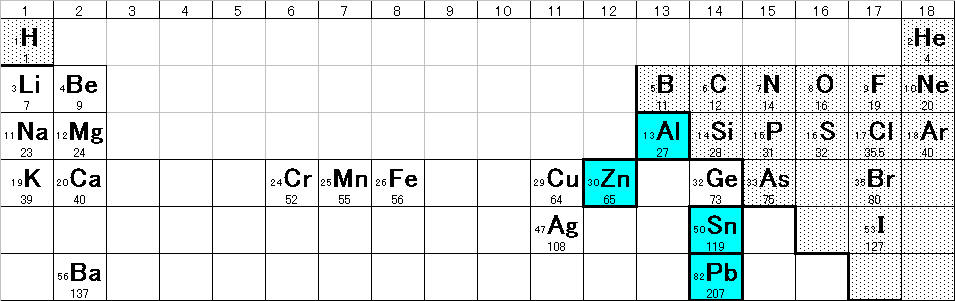
両性元素は、酸にも、塩基にも、溶ける。
2Al+3H2SO4→2Al3++3SO42-+3H2
- [還元剤]Al(0)→Al3+(+3)+3e-
- [酸化剤]2H+(+1)+2e-→H2(0)
- 2Al+6H+→2Al3++3H2
- 2Al+6H++3SO42-→2Al3++3SO42-+3H2
Zn+2HCl→Zn2++2Cl-+H2- [還元剤]Zn(0)→Zn2+(+2)+2e-
- [酸化剤]2H+(+1)+2e-→H2(0)
- Zn+2H+→Zn2++H2
- Zn+2H++2Cl-→Zn2++2Cl-+H2
2Al+2NaOH+6H2O→2Na++2[Al(OH)4]-+3H2
- [還元剤]Al→Al3++3e-
- [酸化剤]2H2O+2e-→H2+2OH-
Zn+2NaOH+2H2O→2Na++[Zn(OH)4]2-+H2
- [還元剤]Zn→Zn2++2e-
- [酸化剤]2H2O+2e-→H2+2OH-
- 炎色反応
原子が加熱され大きなエネルギーを受け取ると、殻外電子が「励起」され、高エネルギー状態に移る。これが再び定常状態に戻るとき、そのエネルギーの差に当たるエネルギーを持つ、特定の波長の電磁波を放出する。アルカリ金属、アルカリ土類金属、および遷移元素の中の銅Cuでは、その波長が「可視光線」の領域に入っているため、「色」として検出できる。波長 長(低エネルギー) 短(高エネルギー)
赤外線 可視光線
7.8×10-7m~3.8×10-7m紫外線 色 - 赤 橙 黄 緑 青 藍 紫 - 炎色反応 - Sr(紅)
Li(赤)Ca(橙赤) Na(黄) Ba(黄緑) Cu(青緑) K(赤紫) -
- ハロゲン
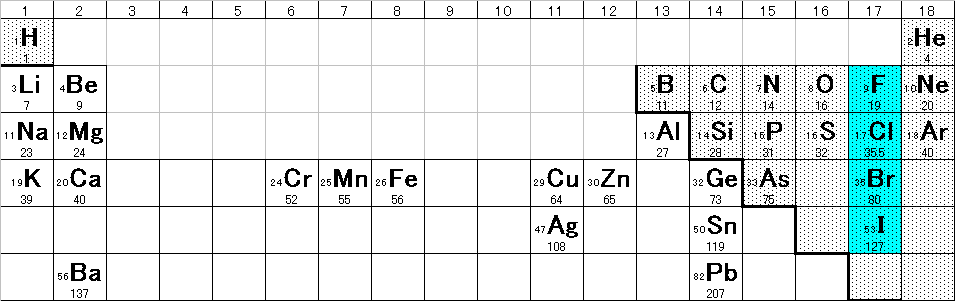
フッ素
F2塩素
Cl2臭素
Br2ヨウ素
I2常温での状態 気体 気体 液体 固体 色 淡黄色 黄緑色 赤褐色 黒紫色 電気陰性度 4.0 3.0 2.8 2.5 酸化力(※1) 大 ← → 小 水素化合物
(ハロゲン化水素)フッ化水素
HF塩化水素
HCl臭化水素
HBrヨウ化水素
HI分子の極性 大 ← → 小 ハロゲン化水素の
水溶液と、その液性フッ化水素酸
(弱酸(※2))塩酸
(強酸)臭化水素酸
(強酸)ヨウ化水素酸
(強酸)
(※1)ハロゲンの酸化力の強さ
2H2O+2F2→O2+4HF:フッ素が「酸素を酸化」している(フッ素は酸素より電気陰性度が大きい唯一の元素である)
2KI+Cl2→2KCl+I2:塩素が酸化剤として作用している(酸化力Cl2>I2)
2KBr+Cl2→2KCl+Br2:塩素が酸化剤として作用している(酸化力Cl2>Br2)
2KI+Br2→2KBr+I2:臭素が酸化剤として作用している(酸化力Br2>I2)
(※2)フッ化水素酸は、あまりにも極性が大きく、(水素結合により)2分子会合しているため、電離が妨げられる。
金属元素・非金属元素の酸化物・水酸化物/両性酸化物・両性水酸化物
周期表の「左・下」側の「金属元素」は、「左」に行くほど「最外殻電子数」が少なく、「下」に行くほど最外殻電子と原子核の距離が大きいから、電子を失って、陽イオンになりやすい。これを「陽性」である、という。
周期表の「右・上」側の「非金属元素」は、「右」に行くほど「最外殻電子数」が安定な「閉殻構造」に近づき、「上」に行くほど最外殻電子と原子核の距離が小さいから、電子を受け取って、陰イオンになりやすい。これを「陰性」である、という。
金属と非金属の境界あたりの金属側に位置している「両性元素」(Al,Zn,Sn,Pb)は、これらの中間的な性質を持っている。
酸素は、フッ素に次いで2番目に「陰性」の強い元素である。一方、水素は、非金属元素の中では、比較的「陰性」の弱い元素である。
酸素は、結合したまわりの元素から、強力に電子を引き寄せようとする。酸素と結合することによって、他の元素のの電子状態が変わり、これによって物質の化学的性質が決まる。
金属酸化物・金属水酸化物は、塩基の性質を持つ。
非金属酸化物・非金属水酸化物は、酸の性質を持つ。
両性酸化物・両性水酸化物は、酸・塩基両方の性質を持つ。
酸化物 水酸化物 金属元素 塩基性酸化物(金属酸化物は「塩基」である) - 水に溶けて水酸化物イオンを発生
(アルカリ金属・アルカリ土類のみ)(1)
CaO+H2O→Ca2++2OH- - 酸と反応する(2)
CuO+H2SO4→Cu2++SO42-+H2O
塩基性水酸化物(金属水酸化物は「塩基」である) - 水に溶けて水酸化物イオンを発生
(アルカリ金属・アルカリ土類のみ)(7)
Ca(OH)2→Ca2++2OH- - 酸と反応する(水酸化物の沈殿が「溶ける」)(8)
Cu(OH)2+H2SO4→Cu2++SO42-+2H2O
両性元素 両性酸化物は「塩基」でもある - 酸と反応する(3)
ZnO+2HCl→Zn2++2Cl-+H2O
両性水酸化物は「塩基」でもある - 酸と反応する(水酸化物の沈殿が「溶ける」)(9)
Zn(OH)2+2HCl→Zn2++2Cl-+2H2O
両性酸化物は「酸」でもある - 塩基と反応する(4)
ZnO+2NaOH+H2O→2Na++[Zn(OH)4]2-
両性水酸化物は「酸」でもある - 塩基と反応する(水酸化物の沈殿が「過剰の水酸化ナトリウムで、溶ける」)(10)
Zn(OH)2+2NaOH→2Na++[Zn(OH)4]2-
非金属元素 酸性酸化物(非金属酸化物は「酸」である) - 水に溶けて水素イオンを発生(5)
(気体:CO2,NO2,SO2,SO3、固体:P2O5)
CO2+H2O→H++HCO3- - CO,NO(気体)、SiO2(固体)は、水に溶けない
- 塩基と反応する(6)
(非金属水酸化物は「酸」である) - 「非金属水酸化物」とは「オキソ酸」のことである(11)
H2SO4→2H++SO42-
- (1)アルカリ金属・アルカリ土類金属の酸化物は、水に溶け、水酸化物イオンOH-を放出する。
いずれも電離度はほぼ1であり、強塩基である。
アルカリ金属
アルカリ土類金属
Na2O+H2O→2Na++2OH-
K2O+H2O→2K++2OH-
CaO+H2O→Ca2++2OH-
BaO+H2O→Ba2++2OH-
- (2)金属酸化物は、「酸」と反応するから、「塩基」である(中和反応)。
(アルカリ金属・アルカリ土類金属以外の金属の酸化物は、水には溶けない)
CaO+2HCl→Ca2++2Cl-+H2O
CuO+H2SO4→Cu2++SO42-+H2O
[注意]イオン化傾向が水素Hより大きい金属は、希酸と反応する。これは「酸化還元反応」である。
Ca+2HCl→Ca2++2Cl-+H2- [還元剤]Ca(0)→Ca2+(+2)+2e-
- [酸化剤]2H+(1)+2e-→H2(0)
- Ca+2H+→Ca2++H2
- Ca+2H++2Cl-→Ca2++2Cl-+H2
- (3)両性酸化物は、「酸」と反応するから、「塩基」である(中和反応)。
(アルカリ金属・アルカリ土類金属以外の金属の酸化物は、水には溶けない)
両性元素
Al2O3+3H2SO4→2Al3++3SO42-+3H2O
ZnO+2HCl→Zn2++2Cl-+H2O
[注意]イオン化傾向が水素Hより大きい金属は、希酸と反応する。これは「酸化還元反応」である。
2Al+3H2SO4→2Al3++3SO42-+3H2- [還元剤]Al(0)→Al3+(+3)+3e-
- [酸化剤]2H+(+1)+2e-→H2(0)
- 2Al+6H+→2Al3++3H2
- 2Al+6H++3SO42-→2Al3++3SO42-+3H2
Zn+2HCl→Zn2++2Cl-+H2- [還元剤]Zn(0)→Zn2+(+2)+2e-
- [酸化剤]2H+(+1)+2e-→H2(0)
- Zn+2H+→Zn2++H2
- Zn+2H++2Cl-→Zn2++2Cl-+H2
- (4)両性酸化物は、「塩基」と反応するから、「酸」である(中和反応)。
Al2O3+2NaOH+3H2O→2Na++2[Al(OH)4]-
ZnO+2NaOH+H2O→2Na++[Zn(OH)4]2-
[Al(OH)4]-:テトラヒドロキソアルミン酸イオン
[Zn(OH)4]2-:テトラヒドロキソ亜鉛酸イオン
[注意]両性元素の単体はは、塩基と反応する。これは「酸化還元反応」である。
2Al+2NaOH+6H2O→2Na++2[Al(OH)4]-+3H2
Zn+2NaOH+2H2O→2Na++[Zn(OH)4]2-+H2
- (5)非金属元素の酸化物は、水に溶けるものも溶けないものもあるが、水に溶けるものは電離して水素イオンH+(オキソニウムイオンH3O+)を放出するから、「酸」である。
非金属元素 酸化物 状態 水溶性・液性 炭素(C) CO 気体 不溶 CO2 気体 溶(弱酸性・炭酸) ケイ素(Si) SiO2 固体(共有結合結晶) 不溶 窒素(N) NO 気体 不溶 NO2 気体(褐色) 溶(強酸性・硝酸) リン(P) P2O5 固体(潮解性) 溶(弱酸性・リン酸) 硫黄(S) SO2 気体 溶(弱酸性・亜硫酸) SO3 昇華性の個体 溶(強酸性・硫酸)
CO2+H2O(2H2CO3)
H++HCO3-
2H++CO32-(炭酸・弱酸)
P2O5+3H2O(2H3PO4)
2H++2H2PO4-
4H++2HPO4-
6H++2PO4-(リン酸・弱酸)
SO2+H2O(2H2SO3)
H++HSO3-
2H++SO32-(亜硫酸・弱酸)
SO3+H2O→(2H2SO4)→2H++SO42-(硫酸・強酸)
※硫酸・硝酸の工業的製法は、それぞれ「接触法」、「オストワルト法」と呼ばれる。この最終段階の反応は、それぞれ三酸化硫黄、二酸化窒素を水に溶かしているが、後者は単なる溶解ではなく、「酸化還元反応」である。
- 「接触法」(硫酸)
単体の硫黄 S や、「黄鉄鉱 FeS2」を酸化して、硫酸が合成される。
S → (酸化) → SO2 → (酸化・触媒V2O5)→ SO3 → (濃硫酸中の水に溶かす) → H2SO4
五酸化二バナジウムV2O5を触媒として、二酸化硫黄を三酸化硫黄に酸化し、濃硫酸中の水と反応させる。
2SO2+O2→2SO3
SO3+H2O→H2SO4
- 「オストワルト法」(硝酸)
NH3 → (酸化・白金触媒) → NO → (酸化)→ NO2 → (水との反応) → HNO3
白金触媒を用いてアンモニアを酸化し、一酸化窒素、さらに二酸化窒素を作る。二酸化窒素を水と反応させて硝酸を得る。
4NH3+5O2→4NO+6H2O
2NO+O2→2NO2
3NO2+H2O→2HNO3+NO
これは、ニ酸化窒素を単に水に溶解するのとは異なり、酸化還元反応である。ここで発生した一酸化窒素は再利用される。
- 「接触法」(硫酸)
- (6)非金属酸化物は、「塩基」と反応するから、「酸」である。
- Ca(OH)2+CO2→CaCO3↓+H2O:石灰水に二酸化炭素を吹き込むと、沈殿ができる。
CaCO3↓+H2O+CO2→Ca(HCO3)2:しかし、さらに吹き込み続けると、沈殿が溶ける。
- 二酸化ケイ素(SiO2、ガラスの主成分)は、水には決して溶けないが、濃い水酸化ナトリウムには少し溶ける。
水酸化ナトリウムをガラスビンに保存することはできるが、ガラス栓を用いるとすり合わせの部分のすりガラスが少し溶けて、ふたが開かなくなってしまう。したがってゴム栓を用いる。
- (7)アルカリ金属・アルカリ土類金属の水酸化物は、水に溶け、水酸化物イオンOH-を放出する。
いずれも電離度はほぼ1であり、強塩基である。
NaOH→Na++OH-
KOH→K++OH-
Ca(OH)2→Ca2++2OH-
Ba(OH)2→Ba2++2OH-
- (8)金属水酸化物は、「酸」と反応するから、「塩基」である(中和反応)。
(アルカリ金属・アルカリ土類金属以外の金属イオンは、すべて、水酸化物イオンで沈殿を生じる。この沈殿が、酸で、溶ける。)
Ca(OH)2+2HCl→Ca2++2Cl-+2H2O
Cu(OH)2+H2SO4→Cu2++SO42-+2H2O
- (9)両性水酸化物は、「酸」と反応するから、「塩基」である(中和反応)。
(アルカリ金属・アルカリ土類金属以外の金属イオンは、すべて、水酸化物イオンで沈殿を生じる。この沈殿が、酸で、溶ける。)
2Al(OH)3+3H2SO4→2Al3++3SO42-+6H2O
Zn(OH)2+2HCl→Zn2++2Cl-+2H2O
- (10)両性水酸化物は、「塩基」と反応するから、「酸」である(中和反応)。
(アルカリ金属・アルカリ土類金属以外の金属イオンは、すべて、水酸化物イオンで沈殿を生じる。この沈殿が、「過剰」な水酸化物イオンで、溶ける。)
Al(OH)3+NaOH→Na++[Al(OH)4]-
Zn(OH)2+2NaOH→2Na++[Zn(OH)4]2-
[Al(OH)4]-:テトラヒドロキソアルミン酸イオン
[Zn(OH)4]2-:テトラヒドロキソ亜鉛酸イオン
- (11)「非金属の水酸化物」とは、「オキソ酸」のことである。
沈殿による金属イオンの分離
- 原則として、イオン化傾向の大きな金属は、沈殿を作りにくく、イオン化傾向の小さな金属は、沈殿を作りやすい。
イオン性物質が、水に「溶ける」のは、極性の大きな水分子が、陽イオンを取り囲み、「水和イオン」を形成するからだ。
- 「アルカリ金属イオンK+,Na+」は一切沈殿しない(だから検出には炎色反応が必要)
- 「アルカリ土類金属イオンCa2+,Ba2+」は、硫酸イオン(SO42-)、炭酸イオン(CO32-)で沈殿
- 「アルカリ金属イオンK+,Na+」、「アルカリ土類金属イオンCa2+,Ba2+」以外の金属イオンは、水酸化物イオン(OH-)で、沈殿する。
- 「両性元素のイオン(Al3+,Zn2+,Sn2+,Pb2+)」特有の問題・・・・・(ア)
少量の塩基(OH-)で沈殿を作るが、過剰の水酸化ナトリウムを加えると、沈殿が溶ける
Al3+→Al(OH)3↓→[Al(OH)4]-(テトラヒドロキソアルミン酸イオン)
Zn2+→Zn(OH)2↓→[Zn(OH)4]2-(テトラヒドロキソ亜鉛酸イオン)
- 「アンモニアの錯イオンを作る金属イオン(Ag+,Zn2+,Cu2+)」特有の問題・・・・・(イ)
少量の塩基(OH-)で沈殿を作るが、過剰のアンモニアを加えると、「錯イオン」を作って沈殿が溶ける
Zn2+→Zn(OH)2↓→[Zn(NH3)4]2+(テトラアンミン亜鉛(Ⅱ)イオン)
Ag+→Ag2O↓→[Ag(NH3)2]+(ジアンミン銀(Ⅰ)イオン)
Cu2+→Cu(OH)2↓→[Cu(NH3)4]2+(テトラアンミン銅(Ⅱ)イオン)
- (ア)(イ)を組み合わせると、複雑な問題が出来上がる
少量の塩基 過剰NaOH 過剰NH3 Al3+ Al(OH)3↓ ○ Al(OH)3↓ Zn2+ Zn(OH)2↓ ○ ○ Ag+ Ag2O↓ Ag2O↓ ○ Cu2+ Cu(OH)2↓ Cu(OH)2↓ ○ Fe2+ Fe(OH)2↓ Fe(OH)2↓ Fe(OH)2↓
- 「硫化物イオン(S2-)」の沈殿にかかわる問題
硫化水素は弱酸だから、水溶液中では以下の平衡にある。
H2S2H++S2-
酸を加えると、H+が過剰になり、これを消費する左向きの反応が進行して、平衡が左に移動する。同時にS2-の濃度も減少する。
塩基を加えると、H+が消費されるので、これを補う右向きの反応が進行し、平衡が右に移動する。S2-の濃度が増加する。
したがって、酸性状態では、溶液中に少量の硫化物イオンしか存在しない。それでも、S2-の沈殿を作るのは、もともとイオン化傾向が低く、そもそも沈殿を形成しやすいものばかりである。(PbS,Ag2S,CuS)
塩基性状態では、溶液中に大量の硫化物イオンが存在する。比較的沈殿を作りにくい、イオン化傾向の大きい金属のイオンも、沈殿し始める。(ZnS,FeS)
硫化水素H2S(-2)は、還元性があるから、水溶液中にFe3+が、存在していたとしてもまず、Fe2+に還元され、FeSとして沈殿する。
- クロム酸イオンとニクロム酸イオン
酸性溶液中ではニクロム酸イオンCr2O72-、塩基性溶液中ではクロム酸イオンCrO42-、として存在する。
これらの反応では、クロムの酸化数は両辺とも+6であり、「酸化還元反応」ではない。2CrO42-+2H+ → Cr2O72-+H2O Cr2O72-+2OH- → 2CrO42-+H2O
少量の
塩基過剰
NaOH過剰
NH3酸性
S2-塩基性
S2-CO32- SO42- Cl- CrO42- Ca2+ ○ ○ ○ ○ ○ CaCO3↓ CaSO4↓ ○ ○ Ba2+ ○ ○ ○ ○ ○ BaCO3↓ BaSO4↓ ○ BaCrO4↓
橙Al3+ Al(OH)3↓ ○ Al(OH)3↓ ○ ○ ○ ○ ○ ○ Zn2+ Zn(OH)2↓ ○ ○ ○ ZnS↓ ○ ○ ○ ○ Pb2+ Pb(OH)2↓ ○ Pb(OH)2↓ PbS↓
黒PbS↓
黒○ PbSO4↓ PbCl2↓ PbCrO4↓
黄Fe2+ Fe(OH)2↓
淡緑Fe(OH)2↓
淡緑Fe(OH)2↓
淡緑○ FeS↓
黒○ ○ ○ ○ Fe3+ Fe(OH)3↓
赤褐Fe(OH)3↓
赤褐Fe(OH)3↓
赤褐○ - ○ ○ ○ ○ Ag+ Ag2O↓
褐Ag2O↓
褐○ Ag2S↓
黒Ag2S↓
黒○ ○ AgCl↓ Ag2CrO4↓
赤褐Cu2+ Cu(OH)2↓
淡青Cu(OH)2↓
淡青○ CuS↓
黒CuS↓
黒○ ○ ○ ○
- 沈殿の色について
遷移元素以外の金属イオンの沈殿は、ほとんど「白色」である。クロム酸イオンの沈殿が「黄色」系であるのは、陰イオン中のクロム(遷移元素)の影響による。
例外は硫化水素の沈殿で、これはほとんどが「黒色」であり、「白色」のZnSが例外である。
物質の製法(無機物質)
物質 製法 水素(H2) - イオン化傾向の大きな金属(K,Ca,Na)に水を加える。(酸化還元反応)
- イオン化傾向が水素より大きい金属(Pbは除く)に希酸(HCl,H2SO4)を加える。(酸化還元反応)
酸素(O2) - 過酸化水素の分解、触媒として酸化マンガン(Ⅳ)MnO2。(酸化還元反応)
- フッ素と水との反応。(酸化還元反応)
塩素(Cl2) - 濃塩酸の酸化マンガン(Ⅳ)MnO2による酸化。(酸化還元反応)
- 次亜塩素酸イオンを含むもの(さらし粉など)と塩酸との反応。(酸化還元反応)
二酸化炭素(CO2) - 炭酸水素ナトリウム(NaHCO3)の加熱分解。
- 炭酸塩に、炭酸より強い酸(カルボン酸、塩酸など)を作用させる。(弱酸塩に強酸を作用させると、弱酸が遊離する)
二酸化硫黄(SO2) - Cu,Agなどの金属に濃硫酸を作用させる。 (酸化還元反応)
一酸化窒素(NO) - Cu,Agなどの金属に希硝酸を作用させる。 (酸化還元反応)
ニ酸化窒素(NO2) - Cu,Agなどの金属に濃硝酸を作用させる。 (酸化還元反応)
塩酸(HCl) - 塩化ナトリウム(NaCl)に濃硫酸を加えて加熱。 (濃硫酸の「不揮発性」)
フッ化水素(HF) - ホタル石(CaF2)に濃硫酸を加えて加熱。 (濃硫酸の「不揮発性」)
硫化水素(H2S) - 硫化鉄(FeS)に強酸(HCl,H2SO4など)を加える。 (弱酸塩に強酸を作用させると、弱酸が遊離する)
アンモニア(NH3) - 塩化アンモニウム(NH4Cl)に強塩基(NaOH,Ca(OH)2など)を加える。 (弱塩基塩に強塩基を作用させると、弱塩基が遊離する)
- 気体の窒素と水素を反応させる(ハーバー・ボッシュ法)。 (工業的製法)
硫酸(H2SO2) - 黄鉄鉱や単体の硫黄を順次酸化して三酸化硫黄を作り、これを水に溶かす(接触法)。 (工業的製法)
硝酸(H2SO2) - アンモニアを順次酸化して二酸化窒素を作り、これを水と反応させる(オストワルト法)。 (工業的製法)
物質 製法 水酸化ナトリウムナトリウム(NaOH) - 食塩水の電気分解(イオン交換膜法)。 (工業的製法)
炭酸ナトリウム(Na2CO3) - 食塩、炭酸カルシウム、アンモニアを原料(アンモニア・ソーダ法)。 (工業的製法)
- 水素(H2)
- イオン化傾向が大きな金属(K,Ca,Na)に水を加える。
[還元剤]Ca→Ca2++2e-
[酸化剤]2H2O+2e-→H2+2OH-
Ca+2H2O→Ca(OH)2+H2
- イオン化傾向が水素より大きい金属(Pbは除く)に希酸(HCl,H2SO4)を加える。
[還元剤]Fe→Fe2++2e-
[酸化剤]2H++2e-→H2
Fe+2H+→Fe2++H2
Fe+H2SO4→FeSO4+H2
- イオン化傾向が大きな金属(K,Ca,Na)に水を加える。
- 酸素(O2)
- 過酸化水素の分解、触媒として酸化マンガン(Ⅳ)MnO2。
[還元剤]H2O2→O2+2e-+2H+
[酸化剤]H2O2+2e-→2OH-
2H2O2→O2+2H2O
- フッ素と水との反応。
[還元剤]2H2O→O2+4e-+4H+
[酸化剤]F2+2e-→2F-
2H2O+2F2→O2+4HF
- 過酸化水素の分解、触媒として酸化マンガン(Ⅳ)MnO2。
- 塩素(Cl2)
- 濃塩酸の酸化マンガン(Ⅳ)MnO2による酸化。
[還元剤]2HCl→Cl2+2e-+2H+
[酸化剤]MnO2+2e-+4H+→Mn2++2H2O
4HCl+MnO2→Cl2+MnCl2+2H2O
- 次亜塩素酸イオンを含むもの(さらし粉など)と塩酸との反応。
[還元剤]2HCl→Cl2+2e-+2H+
[酸化剤]2ClO-+2e-+4H+→Cl2+2H2O
2HCl+2ClO-+2H+→2Cl2+2H2O
例えば、次亜塩素酸ナトリウムならば、
4HCl+2NaClO→2Cl2+2H2O+2NaCl
例えば、さらし粉(CaCl(ClO))ならば、
4HCl+2CaCl(ClO)→2Cl2+2H2O+2CaCl2
- 濃塩酸の酸化マンガン(Ⅳ)MnO2による酸化。
- 二酸化炭素(CO2)
- 炭酸水素ナトリウム(NaHCO3)の加熱分解。
2NaHCO3→Na2CO3+H2O+CO2
- 炭酸塩に、炭酸より強い酸(カルボン酸、塩酸など)を作用させる。
NaHCO3→Na++HCO3-・・・(1)
炭酸水素ナトリウムは完全に電離するので、水溶液中にはHCO3-が大量に存在する。
酢酸(2)、二酸化炭素(3)はいずれも弱酸であるが、(2)のほうが「やや強い」、すなわち電離度が高いから、酢酸の電離によって生じた水素イオンとHCO3-が結合する(3)の左向きの反応が進行し、二酸化炭素が発生する(弱酸塩に強酸を作用させると、弱酸が遊離する)。
CH3COOHCH3COO-+H+・・・(2)
CO2+H2OH++HCO3-・・・(3)
NaHCO3+CH3COOH→CH3COONa+CO2+H2O
- 炭酸水素ナトリウム(NaHCO3)の加熱分解。
- 二酸化硫黄(SO2)、一酸化窒素(NO)、ニ酸化窒素(NO2)
- 二酸化硫黄(SO2)
Cu,Agなどの金属に濃硫酸を作用させる。
[還元剤]Cu→Cu2++2e-
[酸化剤]H2SO4+2e-+2H+→SO2+2H2O
Cu+H2SO4+2H+→Cu2++SO2+2H2O
Cu+2H2SO4→CuSO4+SO2+2H2O
- 一酸化窒素(NO)
Cu,Agなどの金属に希硝酸を作用させる。
[還元剤]Cu→Cu2++2e-
[酸化剤]HNO3+3e-+3H+→NO+2H2O
3Cu+2HNO3+6H+→3Cu2++2NO+4H2O
3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O
- ニ酸化窒素(NO2)
Cu,Agなどの金属に濃硝酸を作用させる。
[還元剤]Cu→Cu2++2e-
[酸化剤]HNO3+e-+H+→NO2+H2O
Cu+2HNO3+2H+→Cu2++2NO2+2H2O
Cu+4HNO3→Cu(NO3)2+2NO2+2H2O
- 二酸化硫黄(SO2)
- 塩酸(HCl)、フッ化水素(HF)
これらの反応は、濃硫酸の「不揮発性」を利用している。
濃硫酸の3つの性質
酸化性・脱水剤・不揮発性
- 塩酸(HCl):塩化ナトリウム(NaCl)に濃硫酸を加えて加熱。
塩化ナトリウムは以下のように電離する。
NaCl→Na++Cl-
濃硫酸の電離度は低いから、それほど電離しないであろう。
H2SO4H++HSO4-
これらを加熱すると、濃硫酸は「不揮発性」であり、熱エネルギーを受け取っても、気体となならない。液体中にあるイオンの組み合わせの中で、気体となってエネルギーを消費できるのは、HClだけであるから、これが気体となって出て行く。
- フッ化水素(HF):ホタル石(CaF2)に濃硫酸を加えて加熱。
- 塩酸(HCl):塩化ナトリウム(NaCl)に濃硫酸を加えて加熱。
- 硫化水素(H2S)
- 硫化鉄(FeS)に強酸(HCl,H2SO4など)を加える
(弱酸塩に強酸を作用させると、弱酸が遊離する)。
FeS+2H+→Fe2++H2S
- ここでは、もう少し簡単に「係数比較」ができてしまう反応式についてみてみよう。
- アンモニア(NH3)の製法
- 塩化アンモニウム(NH4Cl)に強塩基(NaOH,Ca(OH)2など)を加える
。
塩化アンモニウムは、完全に電離するので、水溶液中には、アンモニウムイオン(NH4+)が大量に存在する。
NH4Cl→NH4++Cl-・・・(1)
水酸化ナトリウムは強塩基であるから、(2)の電離から大量の水酸化物イオンが生まれる。
NaOH→Na++OH-・・・(2)
アンモニアは弱塩基であるから、電離度が小さく、アンモニウムイオンと水酸化物イオンが結合する左向きの反応が進行し、アンモニアが発生する(弱塩基塩に強塩基を作用させると、弱塩基が遊離する)。
NH3+H2ONH4++OH-・・・(3)
NH4Cl+NaOH→NH3+NaCl+H2O
- 「ハーバー・ボッシュ法」:気体の窒素と水素から直接アンモニアを合成する。
N2 + 3H2 → 2NH3
- 塩化アンモニウム(NH4Cl)に強塩基(NaOH,Ca(OH)2など)を加える
。
- 硫酸の製法・「接触法」
単体の硫黄 S や、「黄鉄鉱 FeS2」を酸化して、硫酸が合成される。
S → (酸化) → SO2 → (酸化・触媒V2O5)→ SO3 → (濃硫酸中の水に溶かす) → H2SO4
五酸化二バナジウムV2O5を触媒として、二酸化硫黄を三酸化硫黄に酸化し、濃硫酸中の水と反応させる。
S+O2→SO2・・・(1)
2SO2+O2→2SO3・・・(2)
SO3+H2O→H2SO4・・・(3)
接触法の「収率」
中間生成物であるSO2,SO3を消去する。
(1)×2+(2)+(3)×2
2S+3O2+2H2O→2H2SO4
こうして1モルの硫黄から1モルの硫酸が得られることがわかった。
- 硝酸の製法・「オストワルト法」
NH3 → (酸化・白金触媒) → NO → (酸化)→ NO2 → (水との反応) → HNO3
白金触媒を用いてアンモニアを酸化し、一酸化窒素、さらに二酸化窒素を作る。二酸化窒素を水と反応させて硝酸を得る。
4NH3+5O2→4NO+6H2O・・・(1)
2NO+O2→2NO2・・・(2)
3NO2+H2O→2HNO3+NO・・・(3)
これは、ニ酸化窒素を単に水に溶解するのとは異なり、酸化還元反応である。ここで発生した一酸化窒素は再利用される。
オストワルト法の「収率」
NOは、循環して用いられるので、まず、(2)(3)式からNO2を消去する。
(2)×3+(3)×2
4NO+3O2+2H2O→4HNO3・・・(4)
(1)(4)式からNOを消去する。
(1)+(4)
4NH3+8O2→4HNO3+4H2O
NH3+2O2→HNO3+H2O
こうして、(NOの再利用が100%行われるならば)1モルのアンモニアから、1モルの硝酸が得られることがわかった。
- 水酸化ナトリウムの製法・「イオン交換膜法による、塩化ナトリウムの電気分解」
陽極側の電解液には塩化ナトリウム飽和水溶液、陰極側の電解液には水を用い、これらを陽イオン交換膜(陽イオンは透過させるが、陰イオンは透過させない膜)で仕切る。両極ではそれぞれ次の反応が起こる。
陽極:2Cl-→Cl2+2e-
陰極:2H2O+2e-→H2+2OH-
陽極側の電解槽の塩化物イオンや陰極側の電解槽の水酸化物イオンは膜を通れないが、ナトリウムイオンは陽極側から陰極側に移動できる。
陽極側から塩素の気体、陰極側の電解槽から、水酸化ナトリウムを得ることができる。
- 炭酸ナトリウムの製法・「アンモニア・ソーダ法」
- 塩化ナトリウム飽和溶液にアンモニアと二酸化炭素を吸収させる。これらのイオンの組み合わせの中で、最も溶解度の低い「炭酸水素ナトリウム」が沈殿する。(1)
- 石灰石(炭酸カルシウム)を加熱分解すると、酸化カルシウム(生石灰)と二酸化炭素が得られる。(2)
- 酸化カルシウムは水に溶けて、水酸化カルシウム(強塩基)となる。(3)
- (1)で生成した塩化アンモニウムに(強酸弱塩基塩)に水酸化カルシウム(強塩基)を作用させて、アンモニア(弱塩基)を回収し、再利用する。(4)
- 炭酸水素ナトリウムを加熱分解、炭酸ナトリウム、水、二酸化炭素が得られる。(5)
NaCl→Na++Cl-
NH3+H2ONH4++OH-
CO2+H2OH++HCO3-
NaCl+NH3+CO2+H2ONaHCO3+NH4Cl・・・(1)
CaCO3→CaO+CO2・・・(2)
CaO+H2O→Ca(OH)2・・・(3)
2NH4Cl+Ca(OH)2→2NH3+2H2O+CaCl2・・・(4)
2NaHCO3→Na2CO3+H2O+CO2・・・(5)
(1)×2+(2)+(3)+(4)+(5)
2NaCl+CaCO3→Na2CO3+CaCl2
| ソーダ石灰 CaO/NaOH | 塩基性(酸性の気体には使用できない) |
| 塩化カルシウム CaCl2 | 中性(アンモニアは反応するので不可) |
| 濃硫酸 H2SO4 | 酸性(塩基性の気体には使用できない・硫化水素は酸化還元反応を起こすので不可) |
酸化還元反応を利用した金属の製法・精錬
|
人類は歴史上、さまざまな金属単体を利用してきたが、その順番は、ほぼ「イオン化傾向」の逆順になる。
「青銅器文明」から「鉄器文明」を経て、ほぼ20世紀になってから初めてアルミニウムなどの軽金属が利用できるようになった。 理由は簡単だ。20億年ほど前の地球に「光合成」の能力を獲得したシアノバクテリアという藻類が登場し、それが作り出した酸素は、まず、地殻の中の金属単体や、海水中の金属イオンをことごとく酸化した。さらに余った酸素は、大気中に放出され、こうしてやっと生物が「陸」に上がる準備ができた。 人類が登場するはるか前に、地球上の主な金属はすべて「酸化物」になっていた。 イオン化傾向が極めて小さい金属は、酸化を免れて、そのまま単体として掘り出すことができただろうから、人類は比較的早い時期から利用することができた。 「鉄」は、今日用いられている赤鉄鉱の鉱脈はすべて、海水中の鉄イオンが酸化されて沈殿したものだといわれている。 「アルミニウム」のようなイオン化傾向が極めて高い金属も、すべて「酸化物」の形で存在している。 だから、金属単体を「利用する」ためには、「酸化物を還元する」技術が、なければならなかった!! |
- 酸化アルミニウムの融解塩電解
イオン化傾向がHより大きい金属は、水溶液の電気分解では、決して取り出すことができない。これらの金属については、そのイオンを含む塩を、水を加えずに高温で融解し、電気分解を行って取り出す。これを「融解塩電解」と呼ぶ。
アルミニウムは軽くて腐食に強く(酸化皮膜)、展性・延性に富み加工しやすい。
アルミニウムは地殻中に、酸素、ケイ素についで多量に存在するが、ほとんどが酸化物、ケイ酸塩の形をとっており、イオン化傾向が大きいため、単体を取り出す方法がなく、現代にいたるまであまり利用されていなかった。
アルミニウムの鉱石は「ボーキサイト」と呼ばれ、その主成分は酸化アルミニウムAl2O3(アルミナ)である。イオン化傾向の比較的高いアルミニウムが、濃硝酸などの強力な酸化剤にも溶けない(不動態)のは、酸化アルミニウムの皮膜が強力だからだ。
このことからもわかるように、アルミナを融解するのは困難であったが、「氷晶石(Na3AlF6)」に溶かし込むことが可能であることが発見され、これを用いた融解塩電解で大量生産が可能になった。しかし、融解塩電解は、大量の電力を消費するため、コストが大きい。アルミ製品のリサイクルがうまく機能しているのはこのためである。
陽極(炭素):3C+3O2-→3CO+6e-
陰極(炭素):2Al3++6e-→2Al
---------------------------------------------------------
全反応:Al2O3+3C→2Al+3CO
- 鉄の製法
鉄は地中に、主に「赤鉄鉱(Fe2O3)」の形で存在している。
これをまず「高炉」では一酸化炭素(CO)を用いて還元する。ここでできた鉄は不純物が多く、硬いがもろい。これを「銑鉄」という。
次に、「転炉」では、高炉で生じた炭素などの不純物を酸化によって取り除く。こうしてできた鉄が「鋼」である。
- 高炉での反応(赤鉄鉱→銑鉄)
溶鉱炉(高炉)に赤鉄鉱、コークス(石炭を乾留して揮発成分を取り除いた固体)、石灰石(CaCO3)を投入し、高温に加熱する。
コークス(還元剤)、二酸化炭素(酸化剤)の反応により一酸化炭素が発生する。この反応は吸熱反応なので、高温では、右向きの反応が進行し(平衡が右に偏り)大量の一酸化炭素が得られる。
C+CO2→2CO
この一酸化炭素を還元剤として、酸化鉄(Ⅲ)Fe2O3→四酸化三鉄Fe3O4→酸化鉄(Ⅱ)FeO→鉄(銑鉄)Fe、と順次還元される。
3Fe2O3+CO→2Fe3O4+CO2・・・(1)
Fe3O4+CO→3FeO+CO2・・・(2)
FeO+CO→Fe+CO2・・・(3)
(1)+(2)×2+(3)×6
3Fe2O3+9CO→6Fe+9CO2
一方、石灰石は、次のように熱分解する。
CaCO3→CaO+CO2
ここで発生した二酸化炭素は、コークスとともに一酸化炭素を生成する反応に用いられる。
また、酸化カルシウム(生石灰)CaOは、赤鉄鉱に含まれる不純物、酸化アルミニウム(Al2O3)や二酸化ケイ素(SiO2)を除去する役割を果たす。
CaOは金属酸化物であるから「塩基」として機能し、非金属酸化物であるSiO2や両性酸化物であるAl2O3は「酸」として機能し、中和反応が進行するが、同じ金属酸化物であるFe2O3,Fe3O4,FeOなどとは反応しないからである。
- 転炉での反応(銑鉄→鋼)
高炉での反応で、大量の炭素を用いているから、銑鉄には不純物として多くの炭素が含まれる。
転炉では、銑鉄を高温で融解し、酸素を吹き込むことで炭素を酸化して、不純物の少ない鋼を得ている。
- 高炉での反応(赤鉄鉱→銑鉄)
「精錬」とはすでに出来上がった金属単体から不純物を取り除くことである。だから、上の二つのように、「酸化物を還元して単体を取り出す」のとは違う。
不純物を含む「粗銅」を陽極、「純銅」を陰極、硫酸銅(Ⅱ)を電解液として、電気分解を行うと、
陽極:Cu→Cu2++2e-
陰極:Cu2++2e-→Cu
の反応が進行し、陽極の粗銅が溶解し、陰極に純銅が析出する。粗銅に含まれていた不溶性の不純物である金や銀は、陽極の下にたまり(陽極泥)、集めて取り出すことができる。
(3)(2)[金属の製法](1A-2005追)