炭素を含む化合物のことだ。かつては、「生命活動によってしか、決して作り出すことのできない化合物」という定義だったが、尿素(H2N-CO-NH2)の合成にはじまって、さまざまな有機化合物が人工的に作られるようになると、この定義は意味がなくなった。
しかし、生命活動に関与する炭素化合物は膨大な数があり、タンパク質を見ればわかるようにその構造も複雑極まりないので、「炭素化合物」のみを対象とする「有機化学」という分野が、他の化学の分野と独立に、組み立てられている。
こうして、すべての炭素化合物は、二酸化炭素(CO2)のようなよほど単純な化合物以外は、「有機化合物」と呼ばれている。
周期表を見ると、第14族の第2周期、第3周期にはそれぞれ炭素 C 、ケイ素 Si 、が並んでいる。族の番号は「最外殻電子」の数に関係がある。炭素 6C 、ケイ素 14Si の電子配置は、
6C K(2)L(4)
14Si K(2)L(8)M(4)
で、いずれも最外殻電子数が4である。
非金属元素が、他の非金属元素と結合するとき、非金属元素は「陰性元素」で、それぞれ電子を引き寄せようとするから、お互いの間に電子を「共有」しようとするらしい(共有結合)。電子は、「スピン」と呼ばれる回転運動のようなものを行っており、その方向の異なるもの同士は回転に伴う磁力の影響で「対」をつくって安定化するという(共有電子対)。
ところで、周期表を見れば推測できるように、最外殻電子は8個で安定化する、という強力な傾向を持っているらしい(オクテット則)。2個ずつ、4対で8、ここに何か謎がありそうだ。
ペンを4本用意してください。4本のペンの根元はつながっているが、他の端は自由に動けるとしよう。お互い同士が最も離れるように、空間的に配置したとしたら、どんな形をとるだろうか?
4本のペンの先が「正四面体」の頂点をなすような形、ペンとペンのなす角度をθとすると、cosθ=-
|
電子対同士はそれぞれ負に帯電していて、静電気的な反発力を持っているから、この推論には説得力がある。
この世でもっとも硬いものは?ダイヤモンド。そのダイヤモンドがこの「正四面体」構造をとっている。 海岸の護岸に用いられる「テトラポッド」もこの形をしているのは、いろいろな方向から加わる力に対して、この構造がとても「強い」ことを意味しているのではないか? |
これで、ほぼ、謎が解けた。一つの点から4方向に、対等に広がる「正四面体」という構造が、この世界で最も力学的に「安定」な構造であるらしい。だから、最外殻電子が4個で、4方向に共有結合ができる炭素とケイ素が、それぞれ「生物界」、「無生物界」のすべての物質の骨格を決定する元素として、選ばれた。
- すべての生物の身体は、「アミノ酸」という、炭素の周りに4種の原子団が結合した物質を基本単位として、できている。
- 地球の表面付近の、「土、砂、岩、・・・」、つまり生物が作ったものではないすべての構造物は、ケイ素の化合物、二酸化ケイ素やケイ酸塩、でできている。
有機化合物は、炭素を「骨格」として作られるが、それ以外の構成元素としては、水素、酸素、窒素、硫黄、リン、などの非金属元素、いくつかの金属イオンなどがある。おもなものとして、次の3つに分類する。
- 炭化水素( C , H のみで構成されるもの)
- 酸素を含む有機化合物( C , H , O で構成されるもの)
- 窒素・硫黄を含む有機化合物( C , H , O , N , S などで構成されるもの)
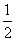 H2
H2
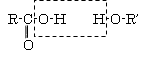
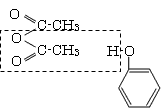
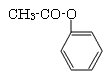 + CH3COOH
+ CH3COOH
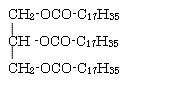

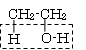
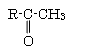
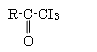
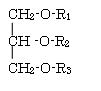
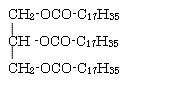 + 3 KOH →
3 C17H35COO-K+ +
+ 3 KOH →
3 C17H35COO-K+ +