- 分子が十分に大きな運動エネルギーを持っているために、広い空間を、大きな速度で移動している。
したがって、分子同士が接近する可能性は極めて小さいと考えてよい。
分子間力はさまざまな要因で生じるが、その本質は、「静電引力」である。静電引力は距離の2乗に反比例する(逆2乗法則)。だから、分子同士がよほど接近しないかぎりその影響は無視できる。 - 容器の形によって、形を変える。分子のまったくランダムな運動によって、容器の隅々までまったく均等に広がる。
二種類以上の分子からなる「混合気体」の場合にも、- それぞれの成分気体が、容器の全体積を占め、
- かつ、他の気体が存在することの影響を、相互にまったく受けない、
したがって、「混合気体」の「分圧」は、その容器にその気体が単独で存在したときに示す圧力と、まったく同じと考えられる。(ドルトンの「分圧の法則」)
成分気体1 成分気体2 混合気体 - 気体の「圧力」とは、運動する分子が容器の壁面に衝突するときに、壁面に加える力を、その壁面の面積で割ったものである。[Pa=N/m2]
したがって、「圧力」は、- 分子が壁面に衝突する頻度(確率)が高いほど、
- 衝突する分子が大きな運動エネルギーを持っているほど、
熱力学によれば、- 気体の「内部エネルギー」(運動エネルギーの総和にほぼ等しい)は、絶対温度に比例する。
- 運動エネルギーは、
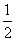 mv2、すなわち、速度の2乗に比例する。
mv2、すなわち、速度の2乗に比例する。
- 容器の壁の間を往復して、再び衝突する時間が短くなるから、衝突確率は高くなり、
- 衝突の際に壁面に加える力も、大きくなる。
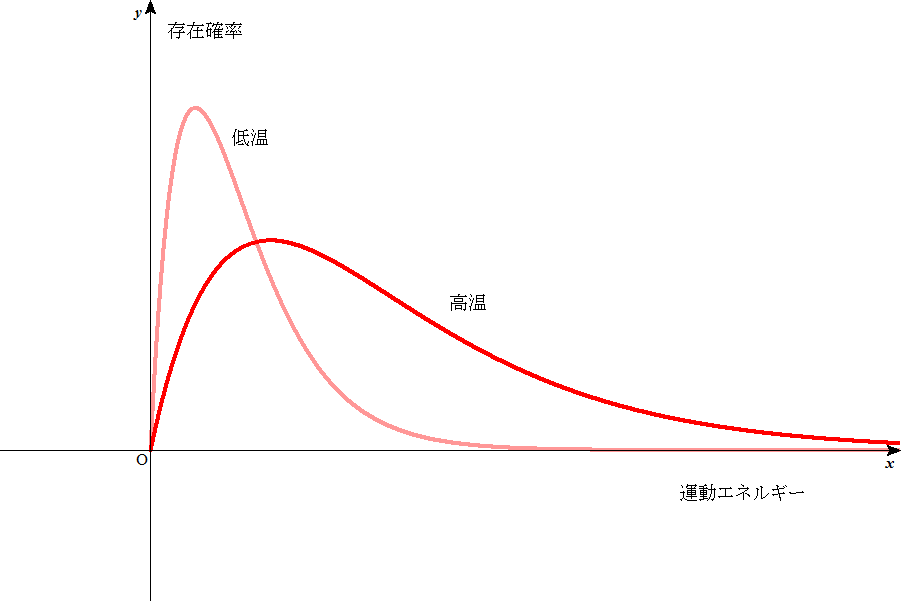
マックスウェル・ボルツマン分布(気体分子のもつエネルギーの分布)
温度が一定の条件の下では、気体の圧力(P)と、体積(V)は、反比例する
圧力一定の条件の下では、気体の占める体積は、温度が1
 上昇するごとに、0
上昇するごとに、0 のときの体積の1/273だけ増加する。
のときの体積の1/273だけ増加する。
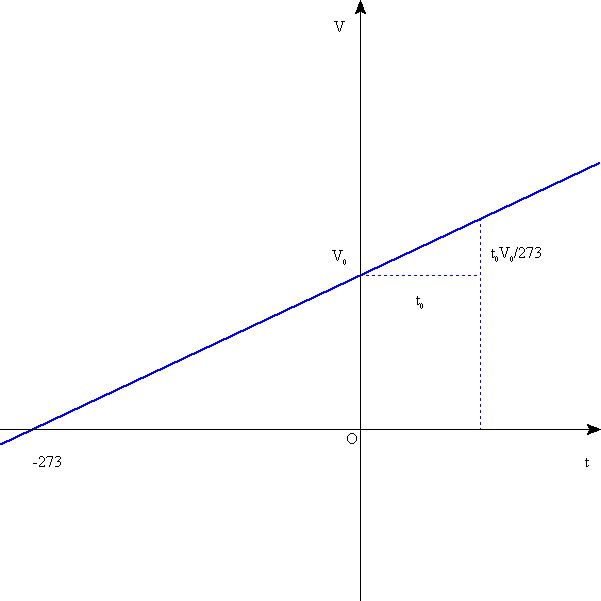
横軸に「摂氏(セルシウス)温度」、縦軸に体積をとってグラフを描くと、原点を通らない1次関数で、その傾きは0
 のときの体積をV0とすると、V0/273、
のときの体積をV0とすると、V0/273、
原点を通らない、つまり「比例関係」ではない法則は、何かと不便なので、このグラフが横軸と交わるポイント、すなわち、摂氏マイナス273度を、原点とする新たな座標軸を採用することにした。
これを「絶対温度」といい、その単位は[K]ケルビン。
こうして、シャルルの法則は、次のように言い換えることができる。
圧力一定の条件の下では、気体の体積(V)は、絶対温度(T)に比例する。
上の二つの法則から、当然に、次のように言える。
 (一定)
(一定)
- 分子間力を無視する。
- 分子自身の大きさを無視する。
- 「アボガドロの法則」によれば、「同温、同圧、同体積の気体には、気体の種類にかかわらず、同数の分子が存在する」。

ならば、ボイル・シャルルの法則の右辺のcは、一定量を決めれば、気体の種類にかかわらず定数となるはずである。 - 質量数12の炭素(126C)は、ほぼ質量が等しい、6個の陽子と、6個の中性子でできている。
その質量は、「何か」の12倍のはずだ。そこで、この炭素原子がいったいいくつ集まれば、質量12gとなるかを調べた。
これが「アボガドロ数」NA=6×1023であり、その「アボガドロ数」個の集団を、「モル」molと名付けた。 - nmolの気体に対して、次の式が成り立つ。
PV=nRT-
P[Pa]:圧力
V[L]:体積
n[mol]:物質量(モル数)
T[K]:絶対温度
気体定数:R=8.31×103
0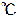 すなわち273K、一気圧(1013hPa、1.013×105Pa)で、1molの気体が占める体積は、
すなわち273K、一気圧(1013hPa、1.013×105Pa)で、1molの気体が占める体積は、
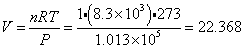
約22.4Lとなる。
理想気体とは、
- 分子間力を無視する。
- 分子自身の大きさを無視する。
- 分子間力が無視できない状況とは?
分子間の距離が非常に小さい、すなわち、非常に狭い空間に分子が押し込められている。
温度が一定なら、ものすごく高圧、または、圧力一定なら、ものすごく低温という状況であろう。 - 分子自身の大きさを無視できない状況とは?
分子がさらに接近して、ほとんど重なりあいが生じているような状況、きわめて高圧、または、絶対零度に近い超低温。
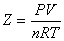
理想気体であるならば、この値は当然1になるはずである。1より大きくなったり、小さくなったりする要因は何か?
圧力P、温度T、もちろん物質量n一定で考えると、この値は体積Vに比例する。
- Zが1より大きいということは、「体積増加要因」が「体積減少要因」より大きな影響を持っている、
- Zが1より小さいということは、「体積減少要因」が「体積増加要因」より大きな影響を持っている、
- 本当は分子間力があって、気体分子が引き合っているのに、これを無視したのだから、分子間力の存在は、「体積減少要因」である。
- 本当は分子に大きさがあるのに、これを無視したのだから、分子の大きさは、「体積増加要因」である。
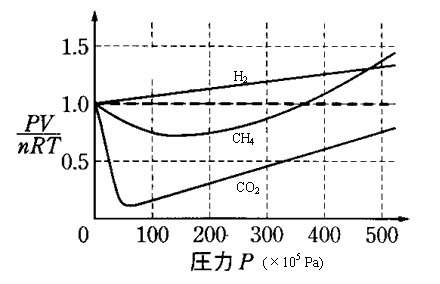
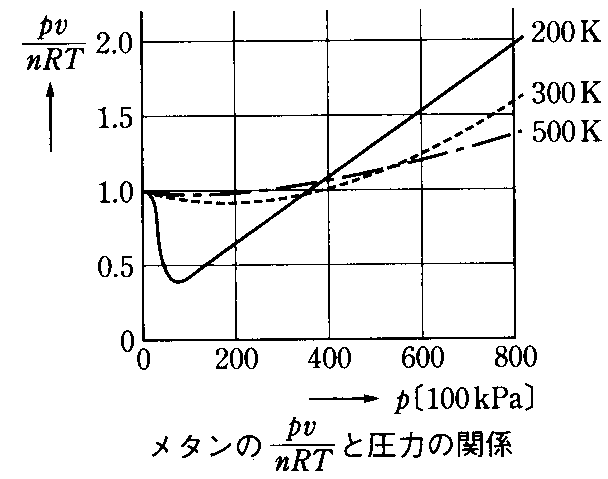
- 上の左のグラフでは、水素H2、メタンCH4、二酸化炭素CO2の0
 =273Kでの「圧縮率因子」を比較したものである。
=273Kでの「圧縮率因子」を比較したものである。
一般に、分子間力は、極性の大きいものの方が大きく、極性が同じくらいならば、分子量が大きいものほど大きい。
これら3種の分子はいずれも無極性であり、分子量はH2=2、CH4=16、CO2=44であるから、この順に分子間力が大きくなる。
圧力が比較的小さいエリアでは、「体積減少」側へのずれていて、中でも分子間力が最も大きい二酸化炭素のずれが激しい。
しかし、圧力があまりに大きくなると、どの気体も「体積増加」側へずれはじめる。 - 右のグラフは、同一の気体、メタンCH4について、温度条件を変えてみた結果である。
摂氏0度よりも低い200Kのときのみ、大きく「体積減少」側にずれているて、温度が高くなるにつれて、その傾向は小さくなる。。
しかし、圧力があまりに大きくなると、どの温度条件でも「体積増加」側へずれはじめる。