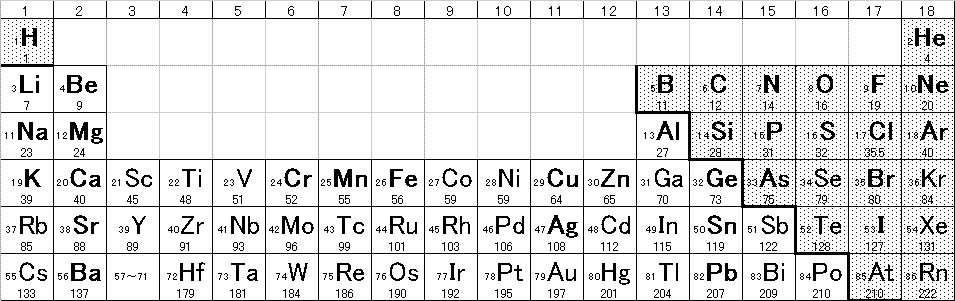
元素を、原子番号(陽子数)の順に並べると、2,8,18・・・個ごと(2=2×12,8=2×22,18=2×32・・・)によく似た性質の元素が現れる。よく似た元素が上下に並ぶように配列したものが周期表。
- 右上に行くほど、電子を引き付ける性質(陰性)が強い。
- 右に行くほど、最外殻電子の配置が「閉殻」(2,8,18・・・個)に近く、
- 上に行くほど、最外殻電子が、原子核に近く大きな静電引力を受けるから、
- 左下に行くほど、電子を放出する性質(陽性)が強い。
- 左に行くほど、最外殻電子数が小さく、
- 下に行くほど、最外殻電子が、原子核から遠く、静電引力の影響が小さくなるから、
- 次の3つの量は、いずれも、右上が大きく、左下が小さい。
- 第1イオン化エネルギー:最外殻電子一個を奪って、1価の陽イオンにするのに、外部から加えなければならないエネルギー(ヘリウムHeが最大)。
- 電子親和力:最外殻に電子一個を付け加えて、1価の陰イオンになるときに、外部に放出されるエネルギー(「希ガス」は除く、フッ素Fが最大)。
- 電気陰性度:第1イオン化エネルギーと電子親和力の平均値(「希ガス」は除く、フッ素Fが最大)。

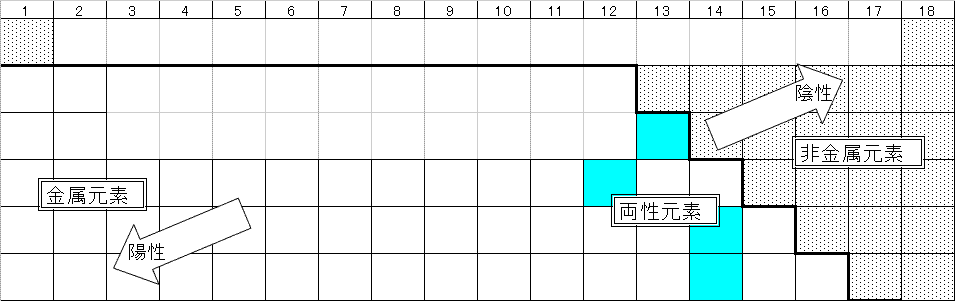
- 金属元素と非金属元素
- 非金属元素は、周期表の右上(陰性元素)に位置している。
- 金属元素は、周期表の左下(陽性元素)に位置している。
- その中間に、両性元素(Al,Zn,Pb,Sn)がある。
- 基本的な化学結合3種
- 非金属元素と非金属元素は、どちらも「陰性」(電子を引き付ける性質)が強いから、
両者の原子核の間に2個の電子からなる「電子対」を共有したまま、結びつく・・・共有結合 - 金属元素と非金属元素は、「陽性」(電子を放出する性質)の強い金属元素が電子を失い、「陰性」(電子を引き付ける性質)の強い非金属元素が電子を受け取って、
陽イオンと陰イオンが、静電引力で結びつく・・・イオン結合 - 金属元素と金属元素は、どちらも「陽性」(電子を放出する性質)が強いから、両者が放出した電子を、固体の中に「自由電子」として閉じ込めたまま、結びつく・・・金属結合
- 非金属元素と非金属元素は、どちらも「陰性」(電子を引き付ける性質)が強いから、
- 「単体」(一種類の元素のみでできた物体)のあり方
- 非金属元素は、同種の2個の原子が共有結合を作って「分子」として存在する。希ガスは1個の原子だけで「分子」を構成する。
すべての非金属単体は、常温常圧(25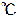 、1.013×105Pa)で気体として存在する。例外は、臭素(Br2):液体、ヨウ素(I2):固体。
、1.013×105Pa)で気体として存在する。例外は、臭素(Br2):液体、ヨウ素(I2):固体。
- 金属元素は、金属結合でできたかたまりとして存在する。常温常圧(25
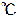 、1.013×105Pa)では、水銀(Hg)のみが液体、他はすべて固体。
、1.013×105Pa)では、水銀(Hg)のみが液体、他はすべて固体。
(「イオン化傾向」(陽性、電子を放出する性質)の特に大きい金属は、単体としてはほとんど存在できず、水溶液中に単独のイオンとして存在したり、非金属元素とイオン結合の化合物を作る。)
- 非金属元素は、同種の2個の原子が共有結合を作って「分子」として存在する。希ガスは1個の原子だけで「分子」を構成する。
- 「化合物」(二種類以上の元素でできた物体)のあり方
- 非金属元素同士の化合物は、共有結合によって「分子」を作る。
異なる元素間には電気陰性度の差があるから、共有される電子対はかならず、どちらか一方の原子側にに偏って存在する。これを「極性」という。「極性」の有無が、分子性物質の性質を大きく左右する。- 電気陰性度の差が大きいほど、「極性」は大きい。
- 立体的に「対称」な構造によって、電荷の偏りが打ち消され「無極性」な分子となることがある。
- 非金属元素と金属元素の化合物は、イオン結合性の物質をつくる。常温常圧(25
 、1.013×105Pa)ではほとんどが固体として存在する。
、1.013×105Pa)ではほとんどが固体として存在する。
水溶液中では、水分子の「極性」によって、陽イオンと陰イオンに「電離」し、単独のイオンになる。「電離」する度合いが小さければ、沈殿として固体のままで存在する。 - 金属元素同士の化合物は、「合金」として、金属結合の固体として存在する。
- 非金属元素同士の化合物は、共有結合によって「分子」を作る。
- 「水」という物質の異常性
- 酸素(O)はすべての元素の中で(フッ素Fについで)二番目に陰性が強い元素である。
- 水素(H)は非金属元素の中でほぼ最低に陰性が弱い。
- その立体構造は折れ線型で、強力な「極性」は打ち消されずに残る。
- 分子性物質としては、沸点、融点が異様に高いこと、電荷を持ったイオンを引き付けて溶かしてしまえること、などが水という極端な「極性溶媒」の特別な性質である。
- 分子性物質の沸点/融点、水溶性
- 分子間力が大きいほど、沸点/融点は高い。
固体から液体、液体から気体へと、より自由に分子が動けるようにするために、より多くのエネルギーが必要だから。 - 分子間力の大きさは、
- まず、「極性」の大きさ、・・・(「極性」が大きいほど、静電引力が大きく、分子間力が大きくなる)
- 次に、分子量によって、・・・(分子量が大きいほど、分子間力は大きくなる)
- 水自身が異常に極性が大きい溶媒だから、同じく極性の大きい物質の方が、水に溶けやすい。
- 分子間力が大きいほど、沸点/融点は高い。
- その他の化学結合
- 配位結合:一方の原子のみが「電子対」を供給し、他方は何も供給しないまま、見かけ上は共有結合と区別がつかない形で結合する。
- アンモニア分子(NH3)の窒素の「非共有電子対」に、水素イオン(H+)が「配位」して、アンモニウムイオン(NH4+)
- 水分子(H2O)の酸素の「非共有電子対」に、水素イオン(H+)が「配位」して、オキソニウムイオン(H3O+)
- 水素結合
- 水素(H)は非金属元素の中では、ほぼ最低に近いくらい陰性が弱い。
- 水素に隣接して、強力な陰性元素である酸素(O)、窒素(N)などが存在すると、強力な「極性」が生じる。
同じように「極性」を持った物質との間に、静電引力に基づく結合が生じる。
水(H3O)やヒドロキシル基(R-OH)のO-H構造、アンモニア(NH3)やアミノ基(R-NH2)のN-H構造、は水素結合を作る。
- 配位結合:一方の原子のみが「電子対」を供給し、他方は何も供給しないまま、見かけ上は共有結合と区別がつかない形で結合する。