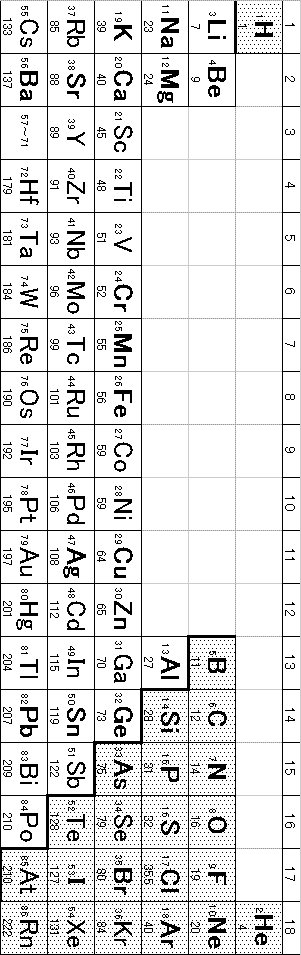
(5)(2009追1_1_a)

(3)(2009追1_1_b)

(4)(2009追1_1_c)

(2)(2009追1_2)

(5)(2009追1_3)

(4)(2009追1_4)

(3)(2009追1_5)


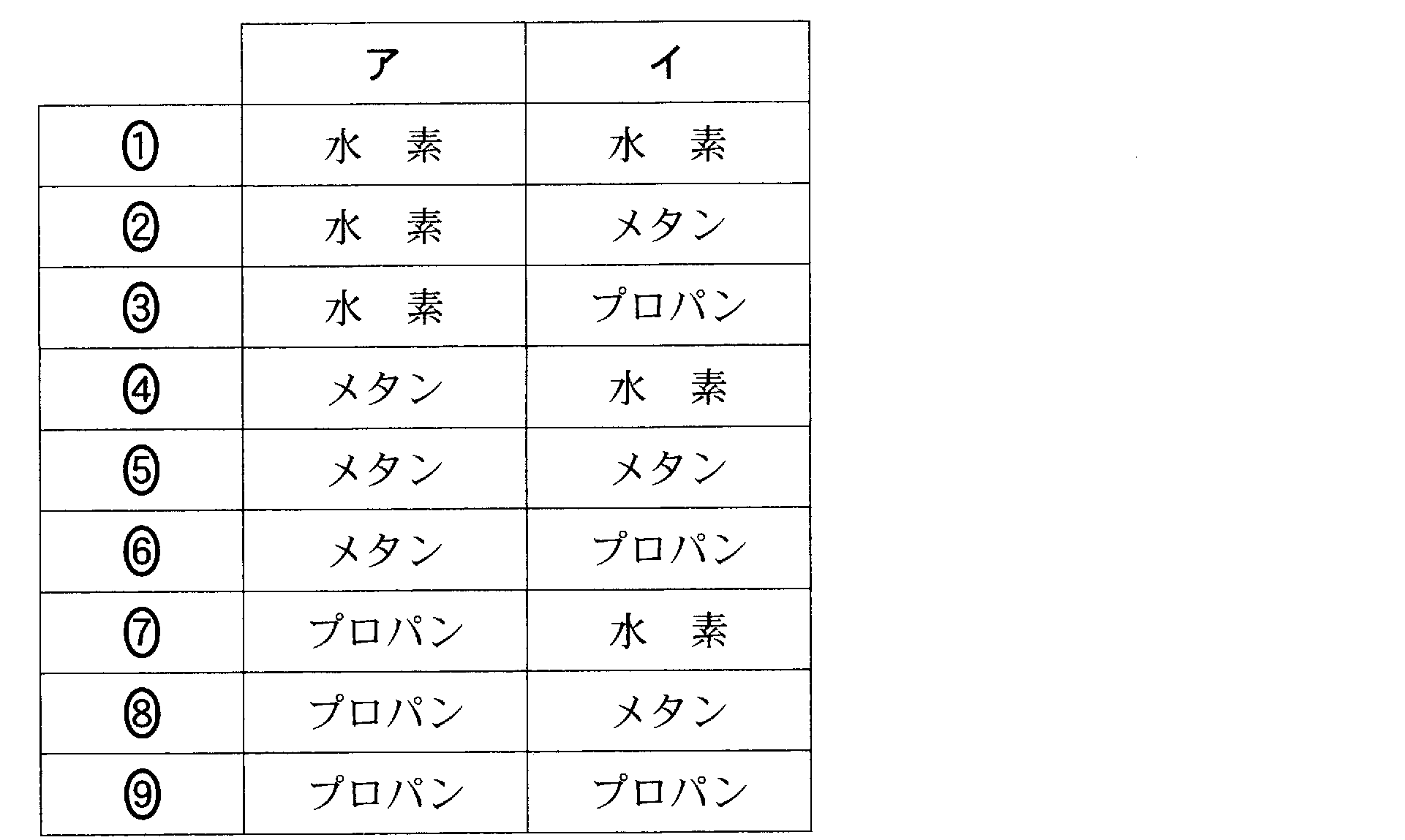

(3)(3)(2009追2_1)



(3)(5)(2009追2_2)
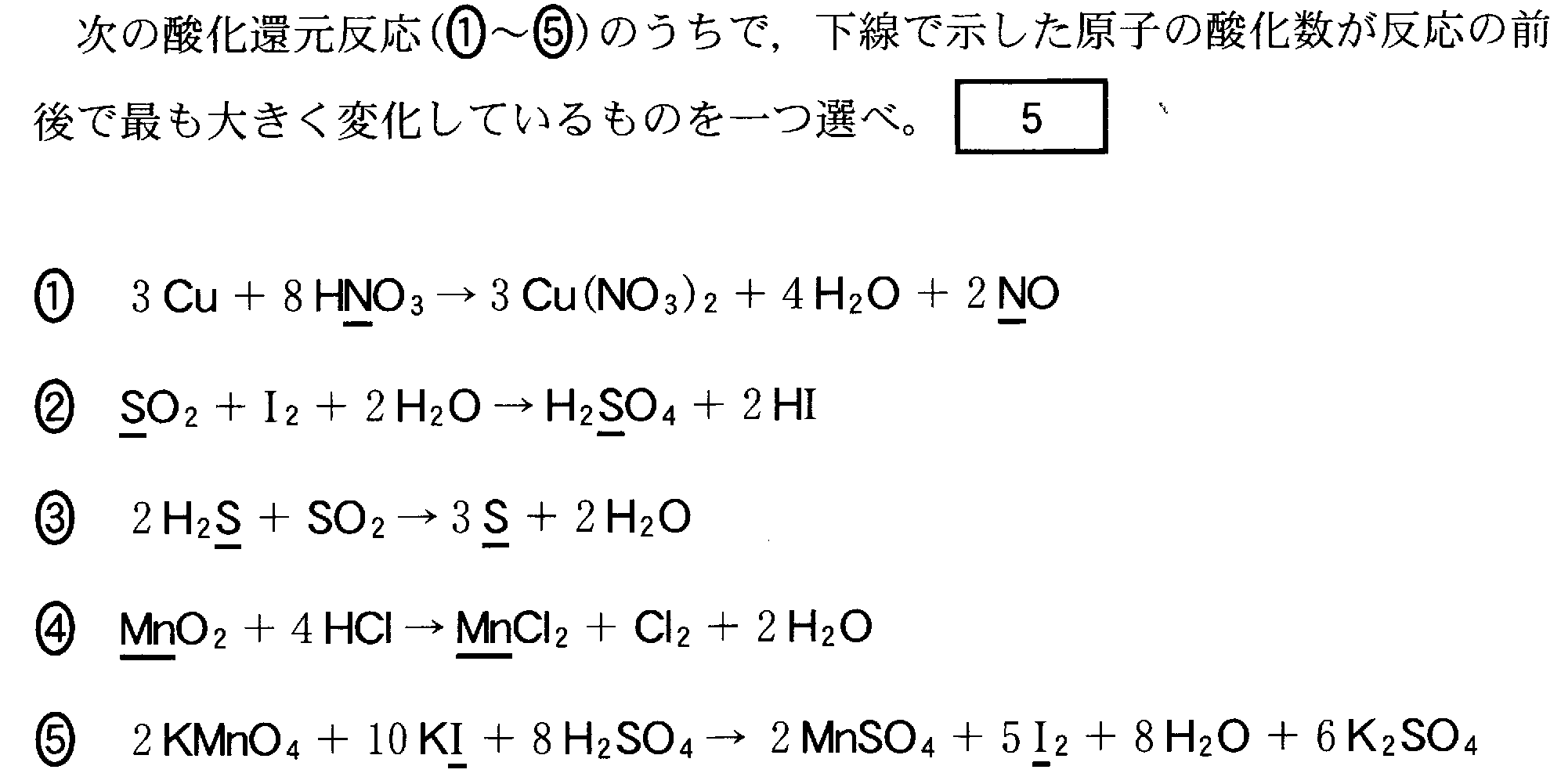
(1)(2009追2_3)
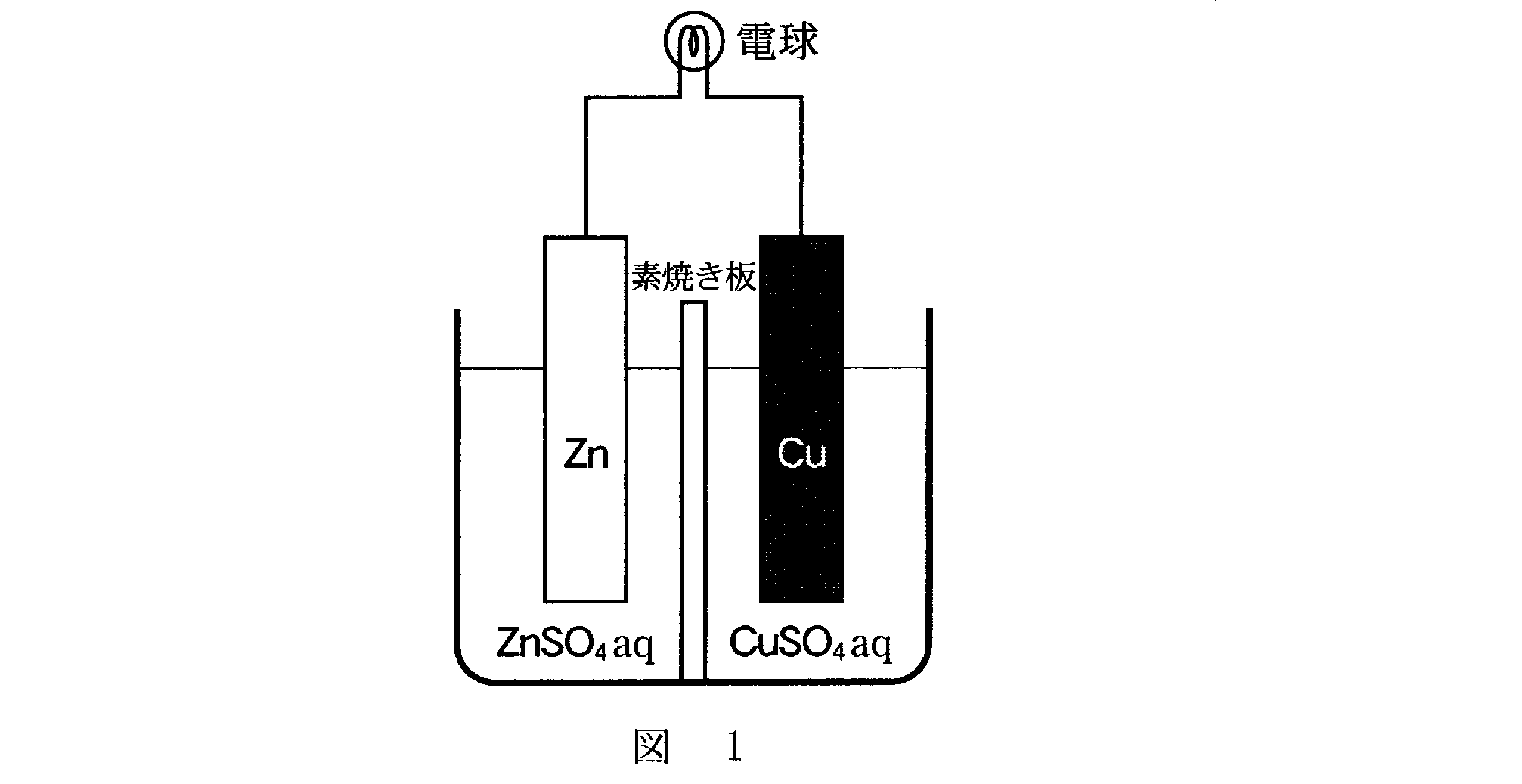
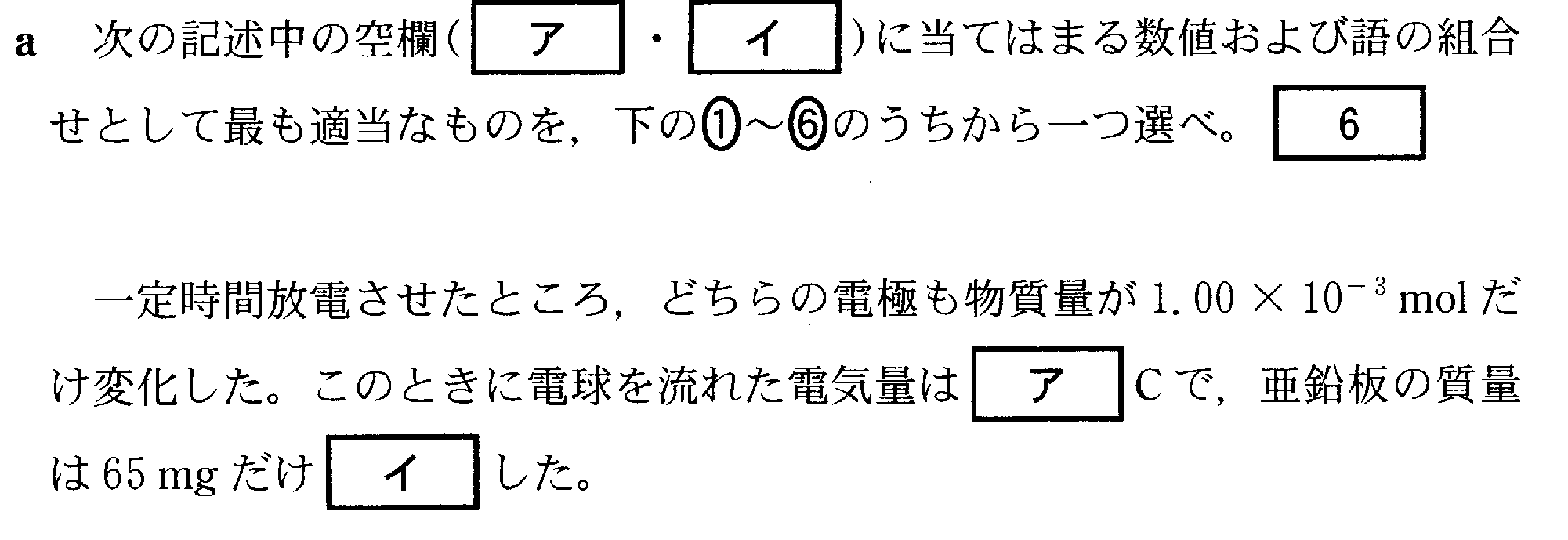
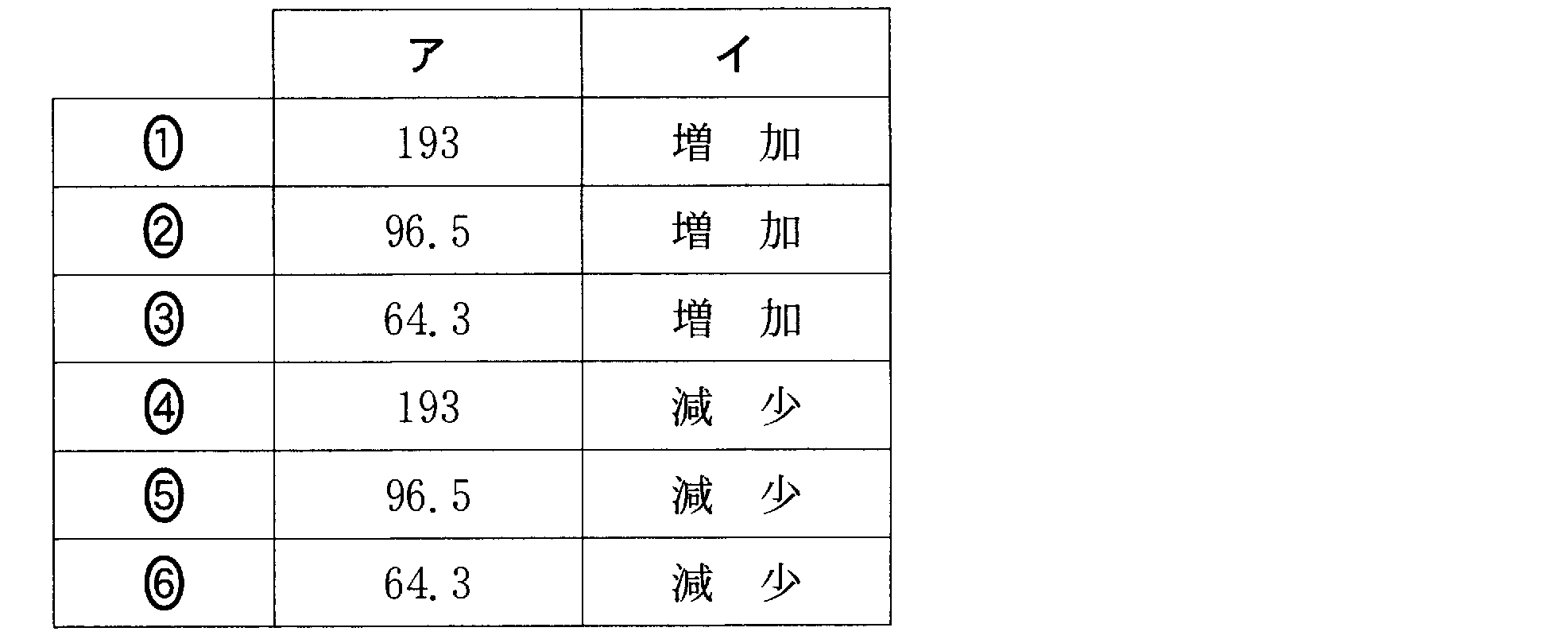

(4)(2)(2009追2_4)

(2)(2009追3_1)

(4)(1)(2009追3_2)

(2)(2009追3_3)

(5)(2009追3_4)

(4)(2009追3_5)

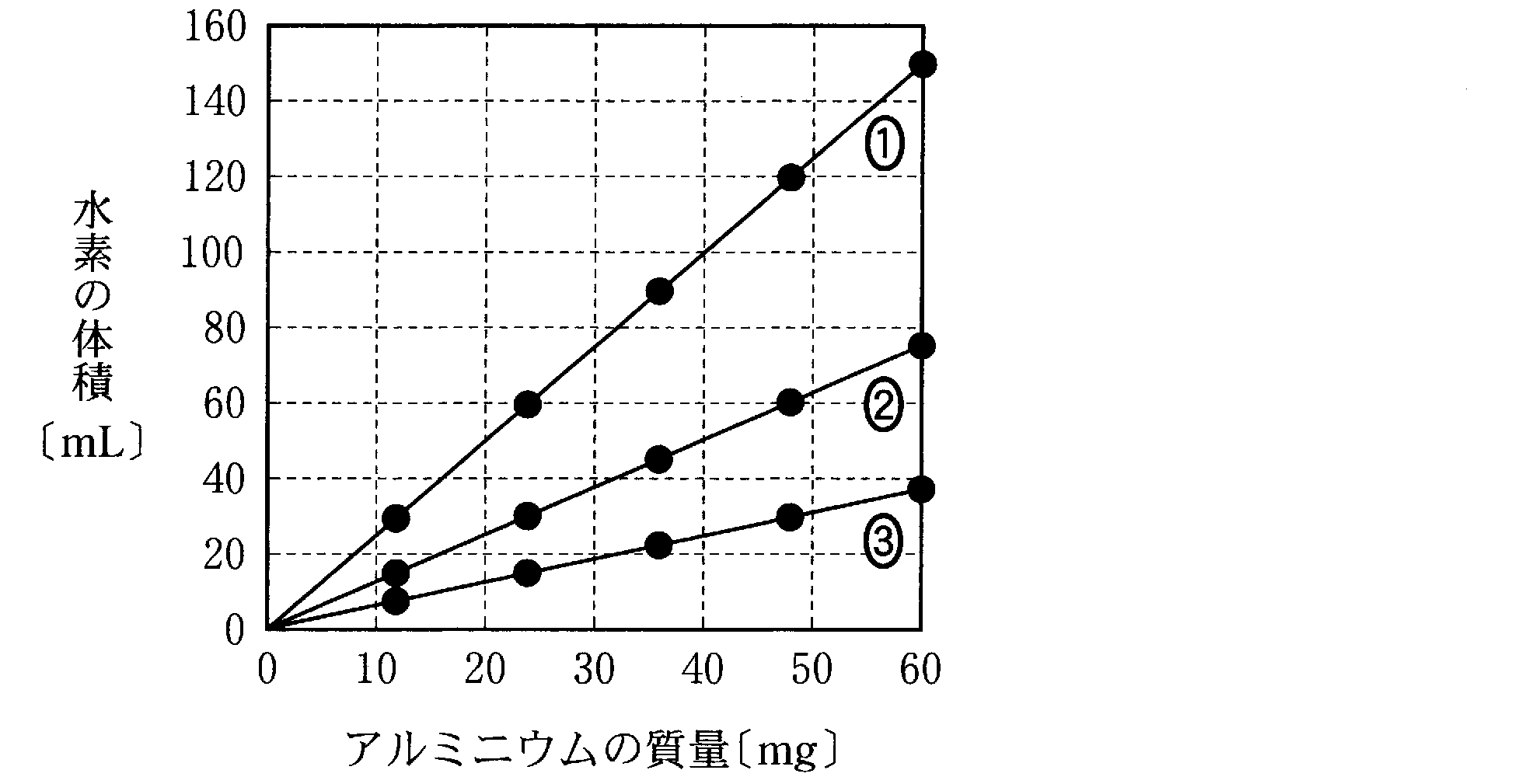
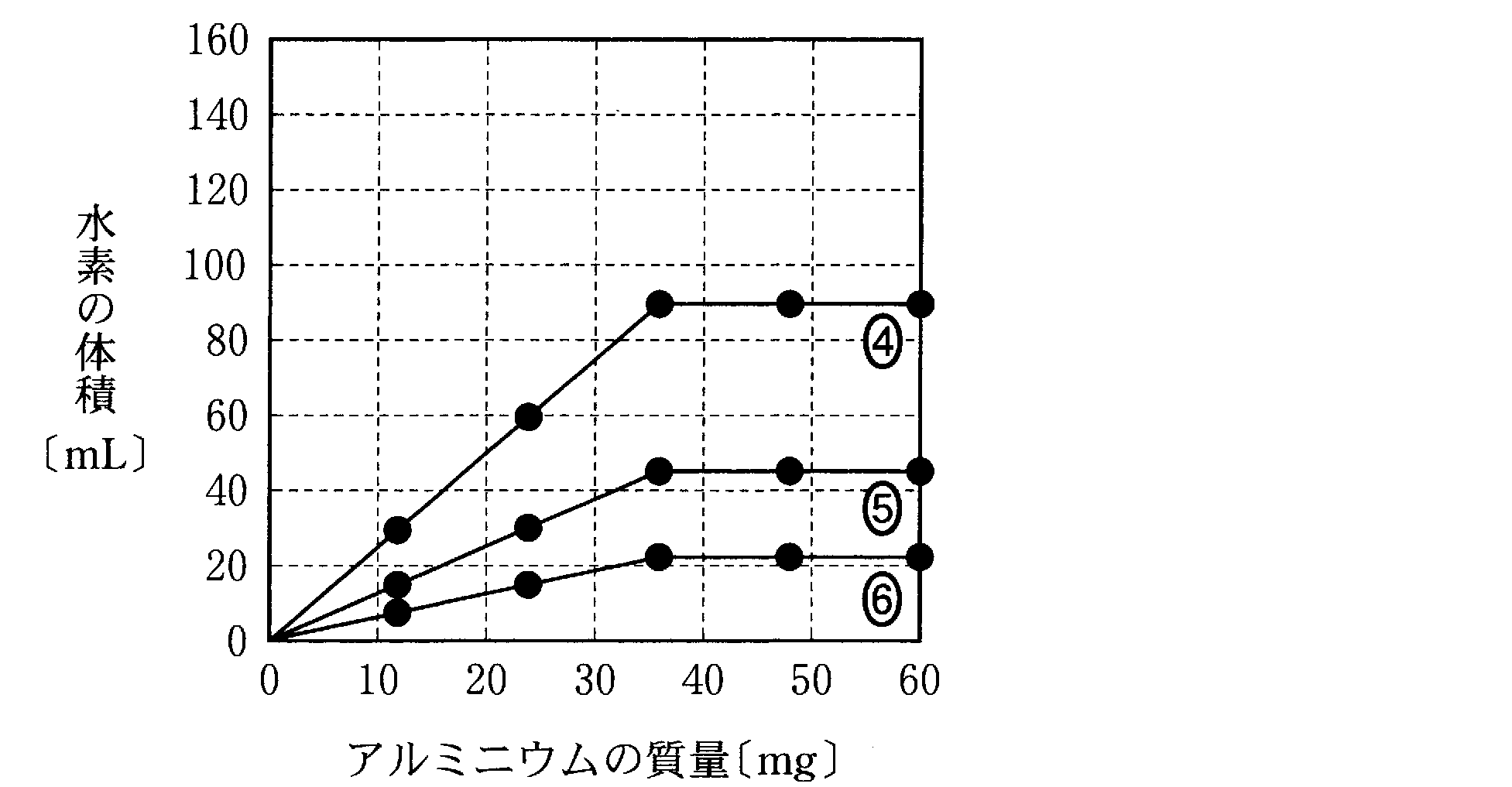
(2)(2009追3_6)

(5)(2009追4_1)
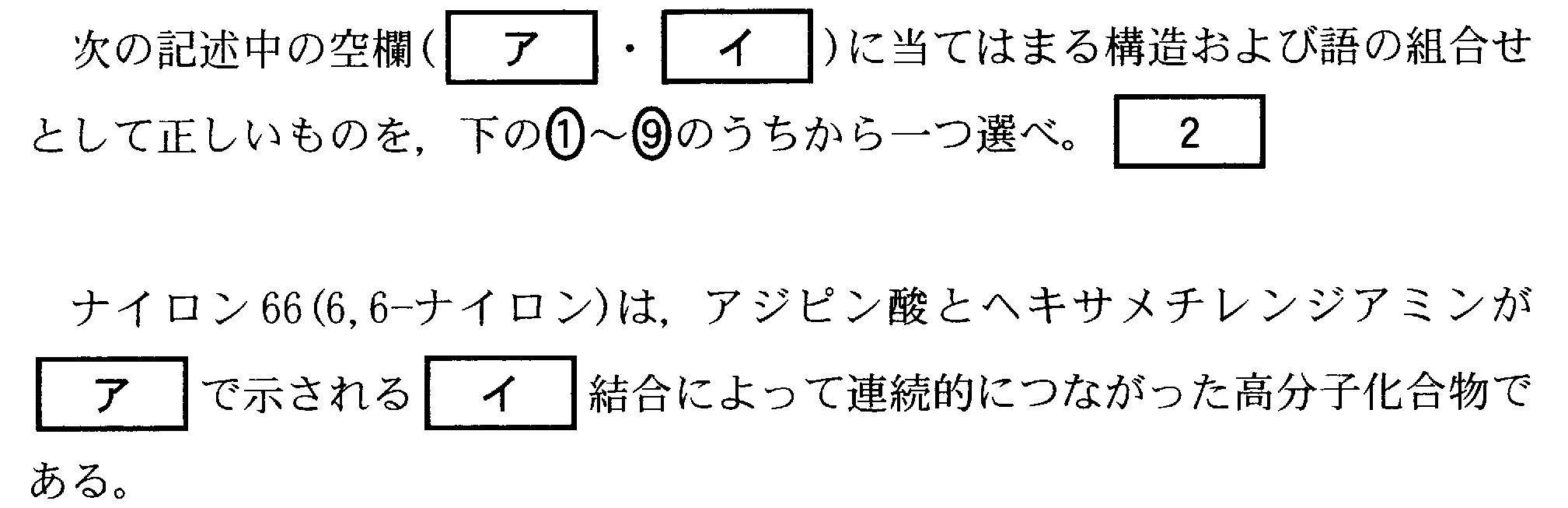
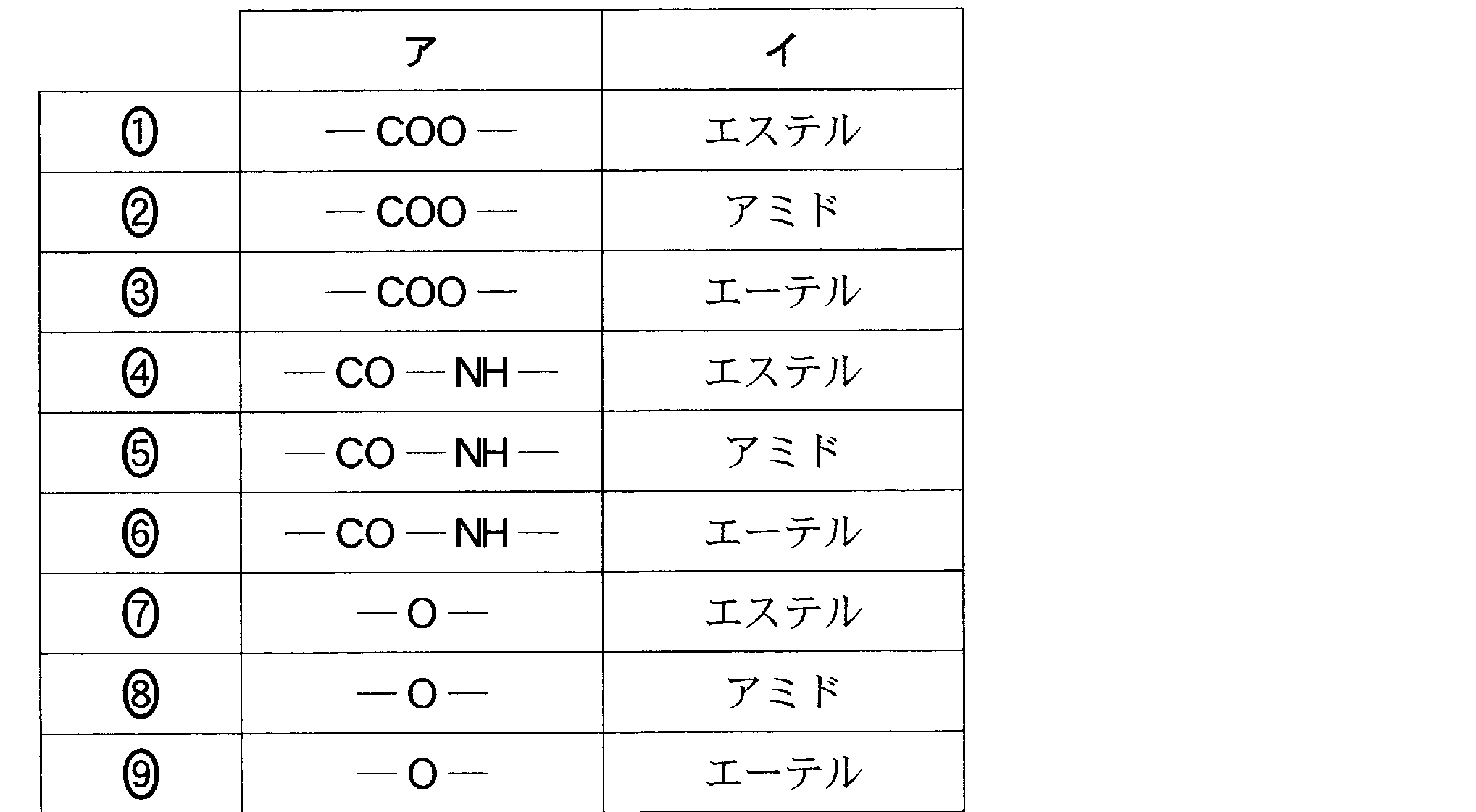
(5)(2009追4_2)

(3)(2009追4_3)

(5)(2009追4_4)


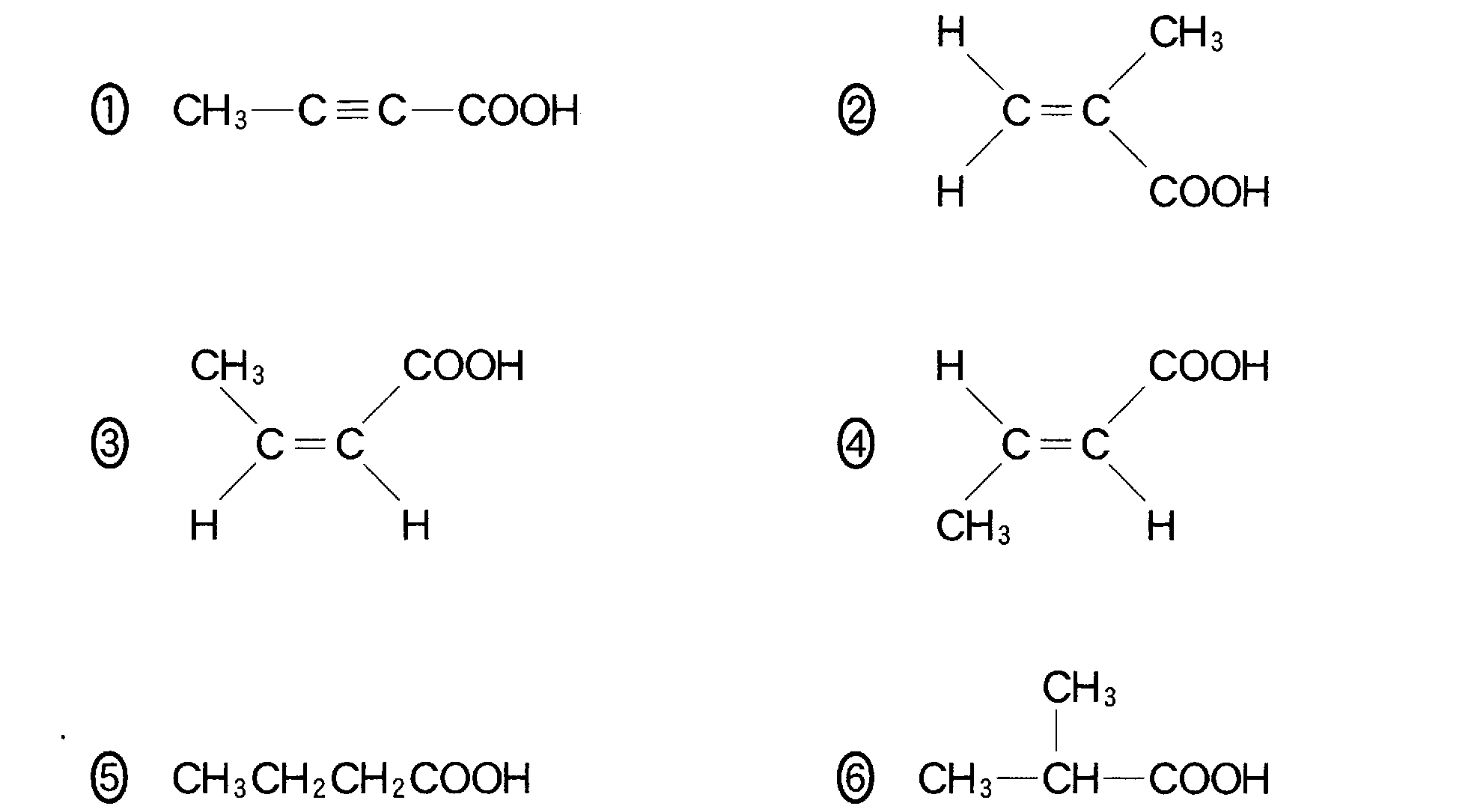
(1)(2)(2009追4_5)

(6)(2009追4_6)

(4)(2010本1_1a)

(6)(2010本1_1b)
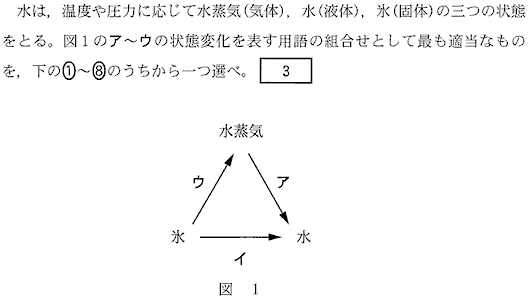
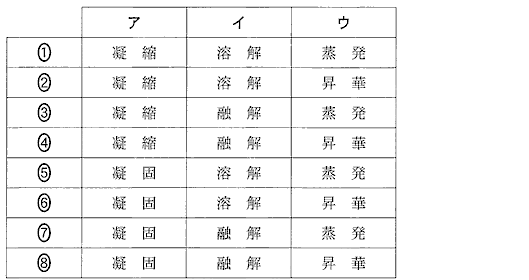
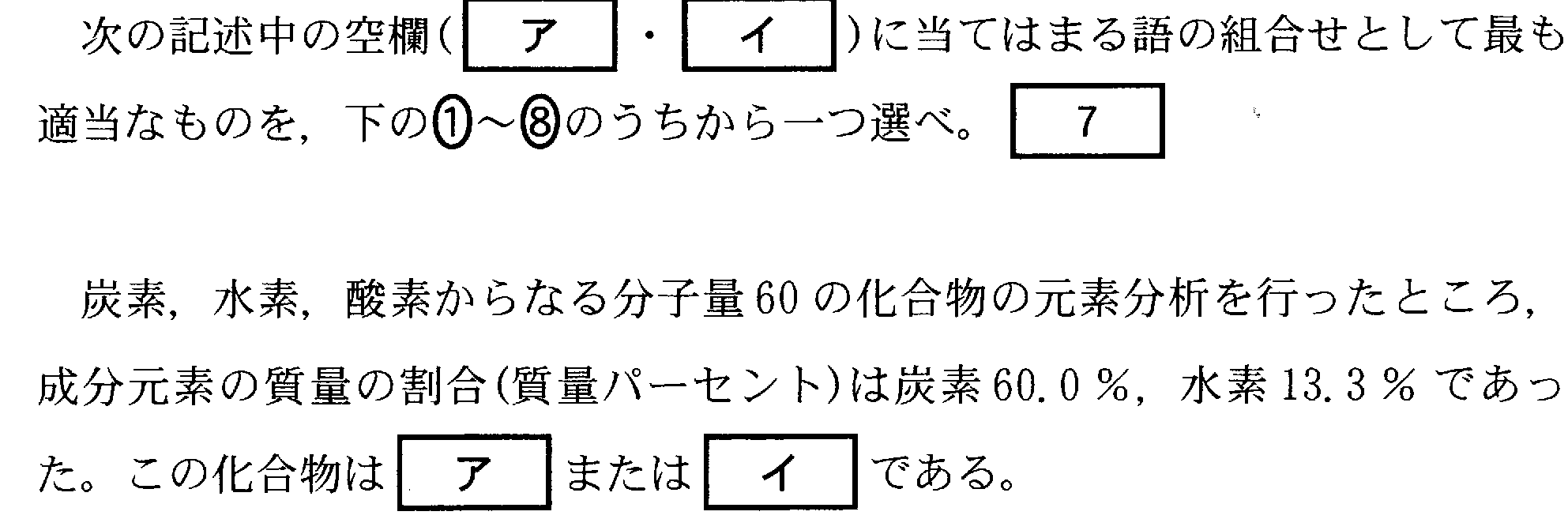
(4)(2010本1_2)
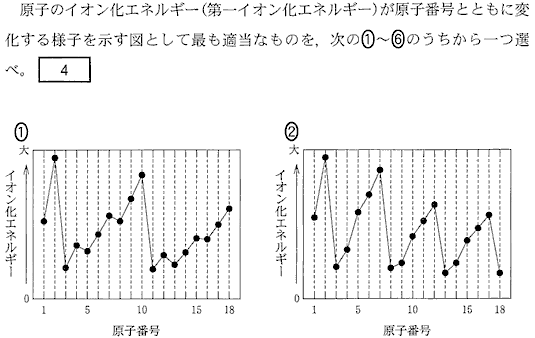
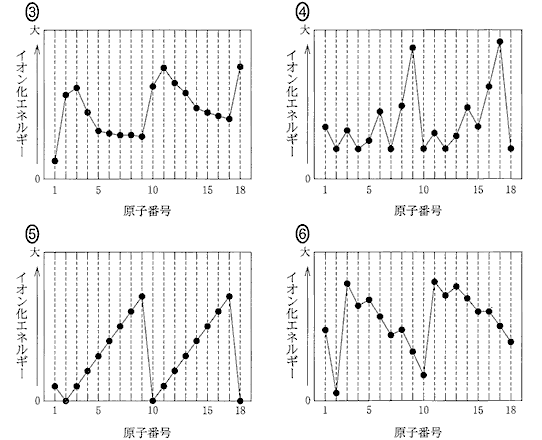
(1)(2010本1_3)

(2)(2010本1_4)

(4)(2010本1_5)

(6)(2010本1_6)

(4)(2010本2_1)
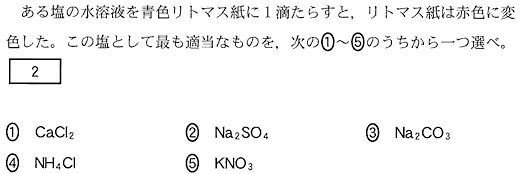
(4)(2010本2_2a)

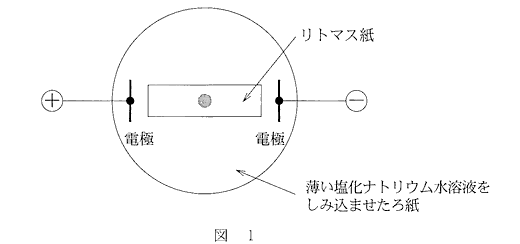
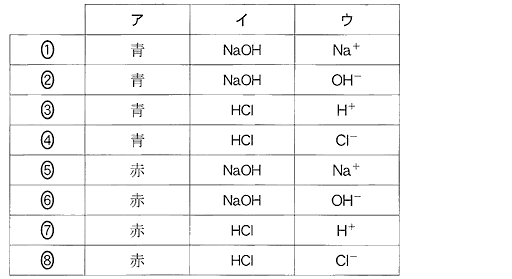
(6)(2010本2_2b)

(2)(2010本2_3a)
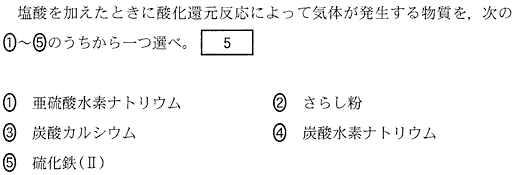
(2)(2010本2_3b)
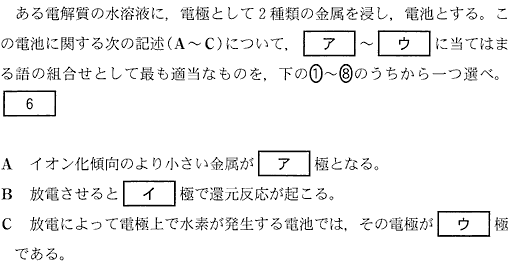
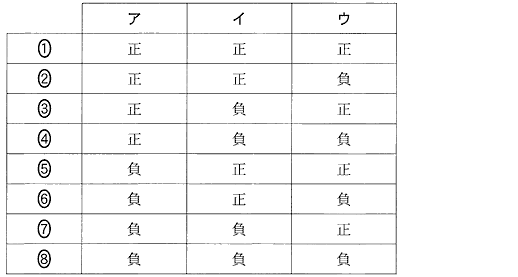
(1)(2010本2_4a)
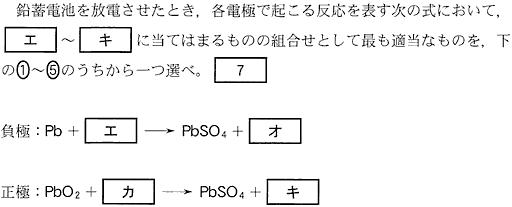
(3)(2010本2_4b)

(1)(2010本3_1)

(3)(2010本3_2)

(4)(2010本3_3a)

(3)(2010本3_3b)

(5)(2010本3_4)

(5)(2010本3_5)
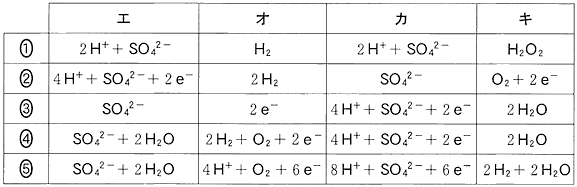
(5)(2010本3_6)

(3)(2010本4_1)


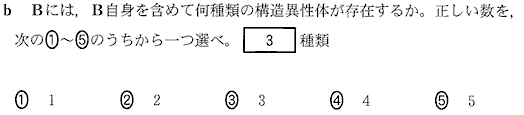
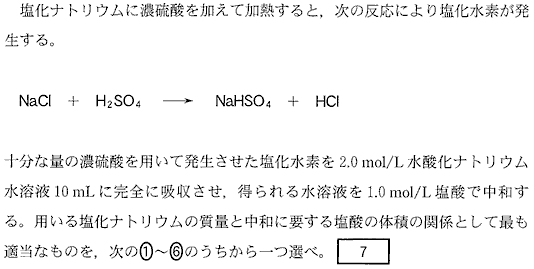
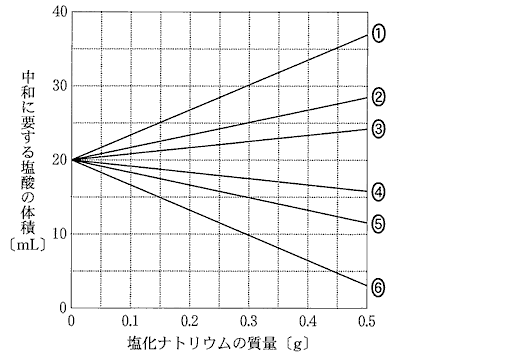
(2)(3)(2010本4_2)

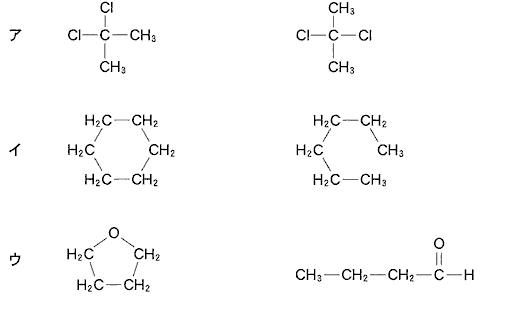
(3)(2010本4_3)
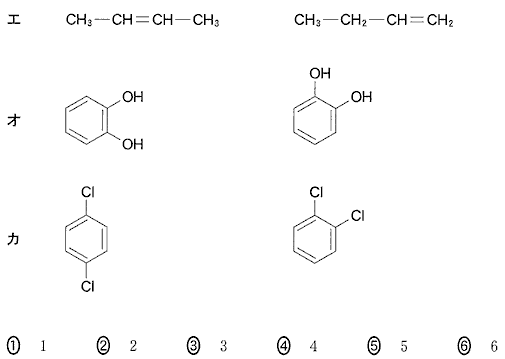
(2)(2010本4_4)


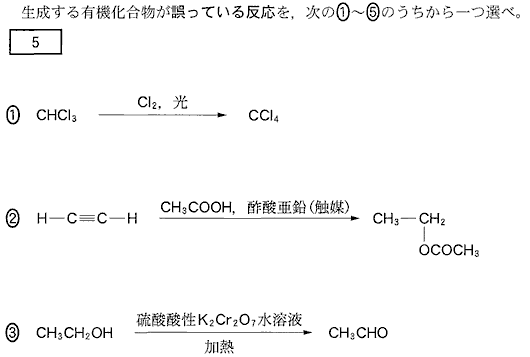
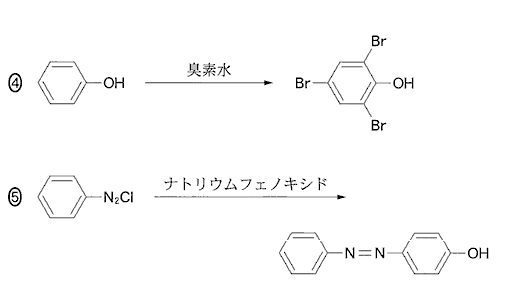
(2)(2010本4_5)

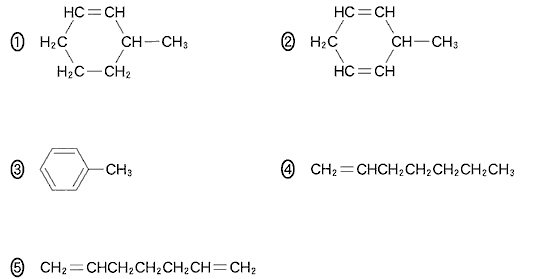
(5)(2010本4_6)
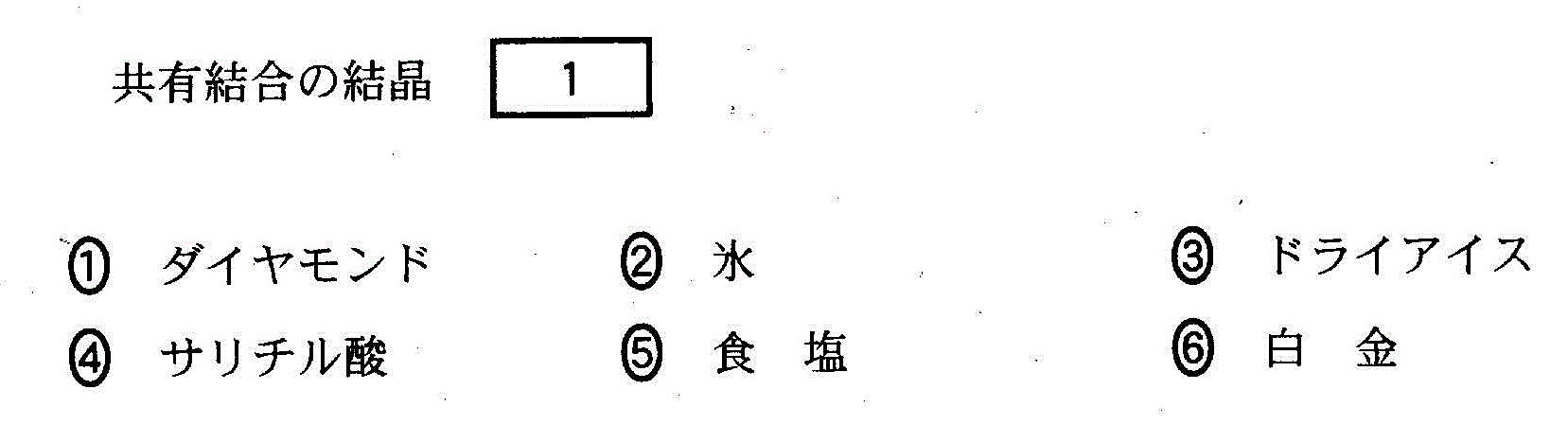
(1)(2010追1_1_a)

(3)(2010追1_1_b)


(8)(2010追1_2)

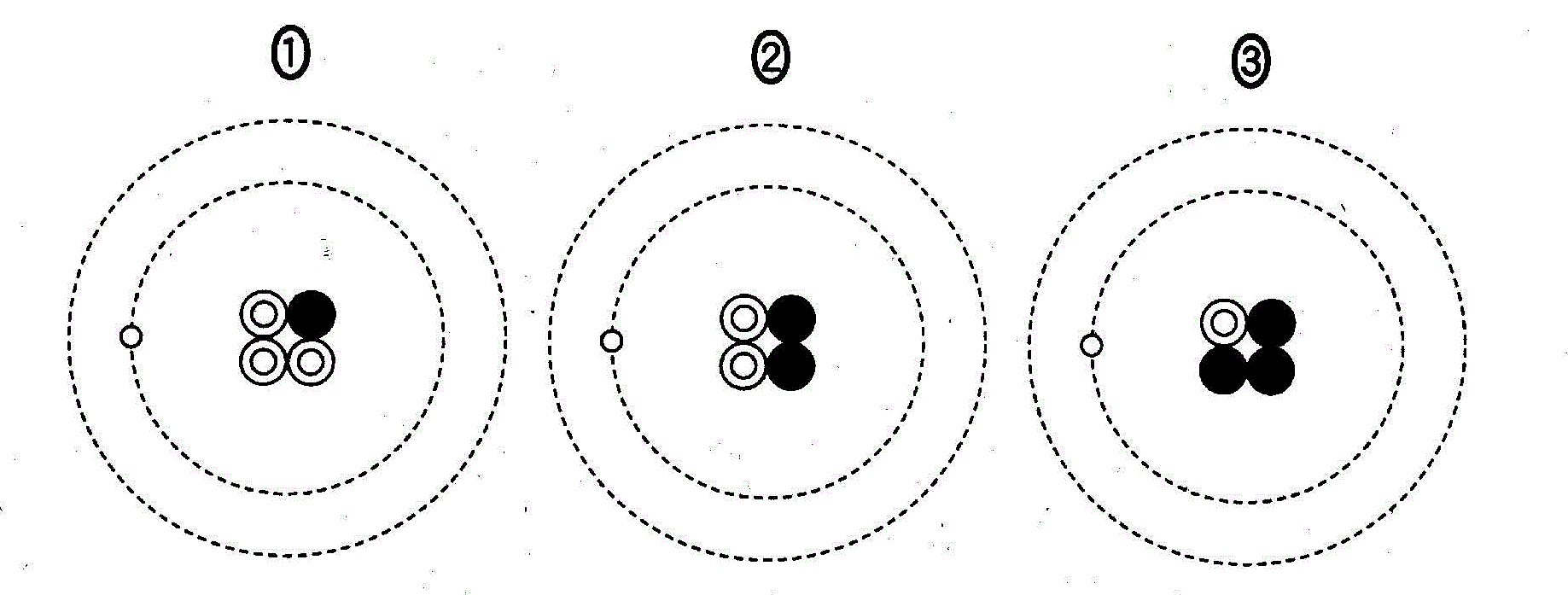
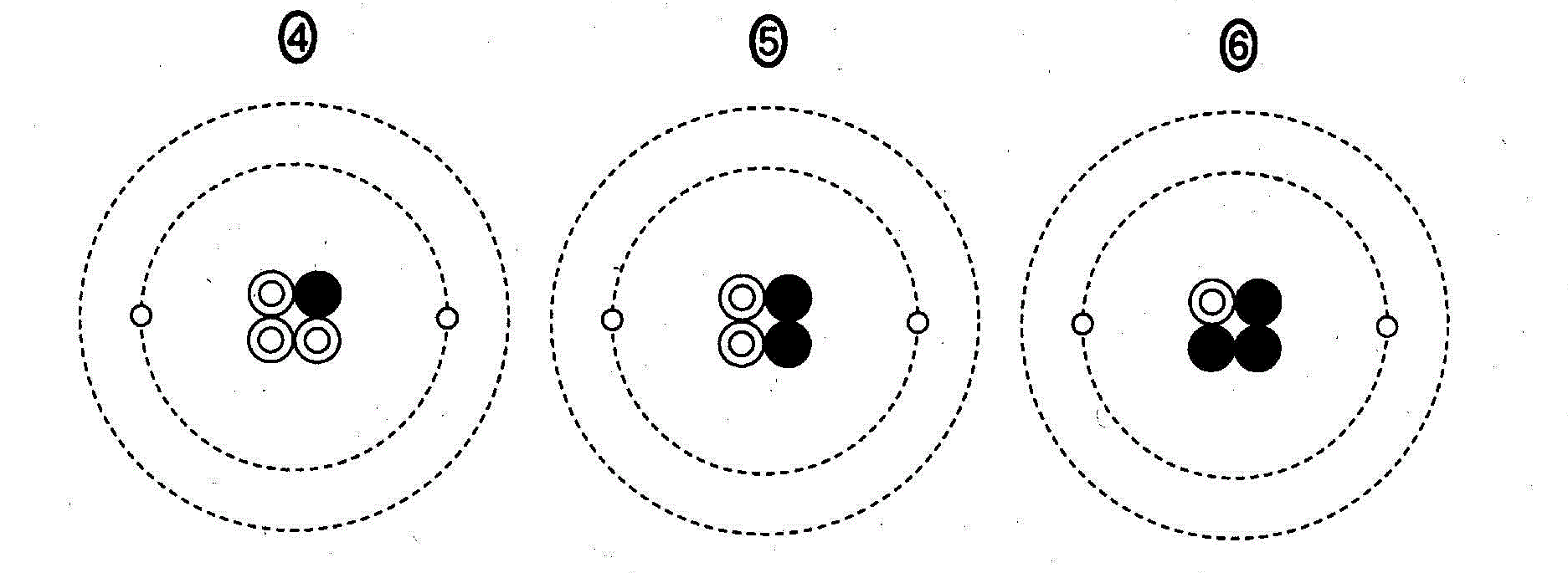

(2)(2010追1_3)
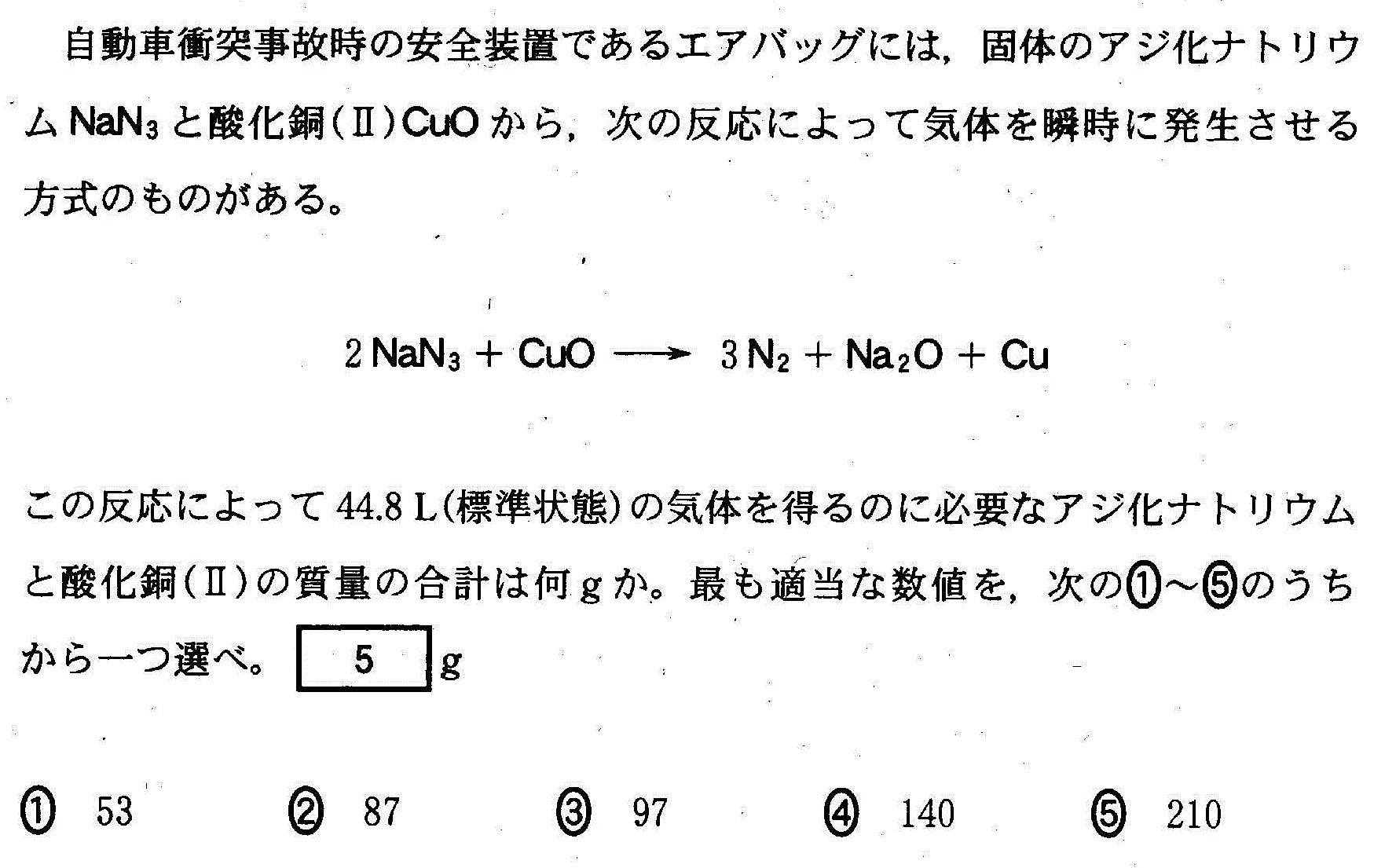
(4)(2010追1_4)

(2)(2010追1_5)

(2)(2010追1_6)


(2)(2010追2_1_a)

(2)(2010追2_1_b)

(4)(2010追2_2_a)

(3)(2010追2_2_b)

(3)(2010追2_3_a)

(1)(2010追2_3_b)
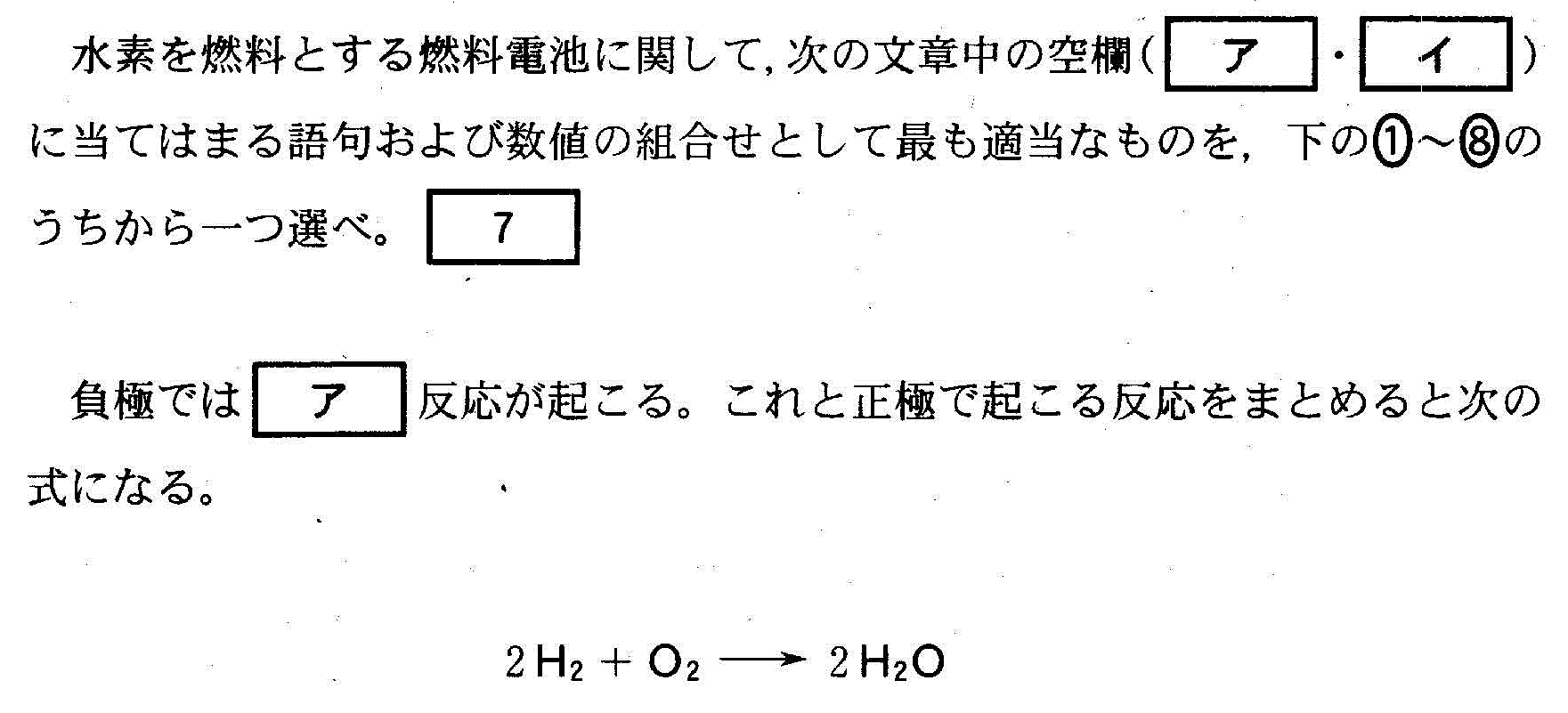

(3)(2010追2_4)

(6)(2010追3_1_a)

(5)(2010追3_1_b)

(4)(2010追3_2_a)
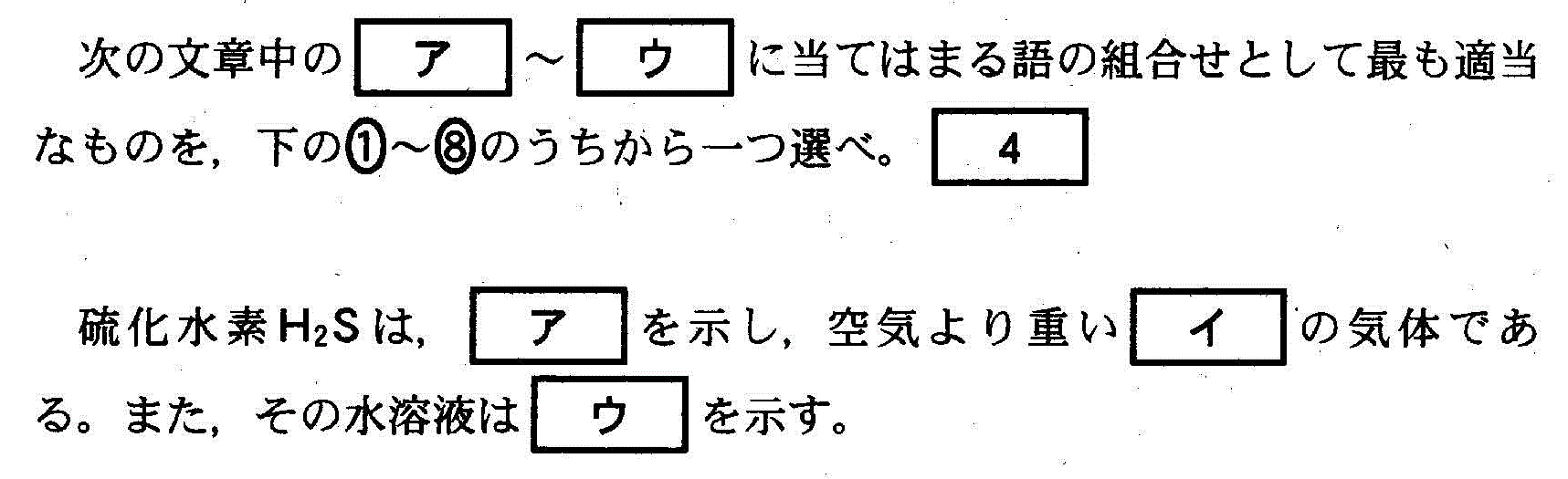

(5)(2010追3_2_b)

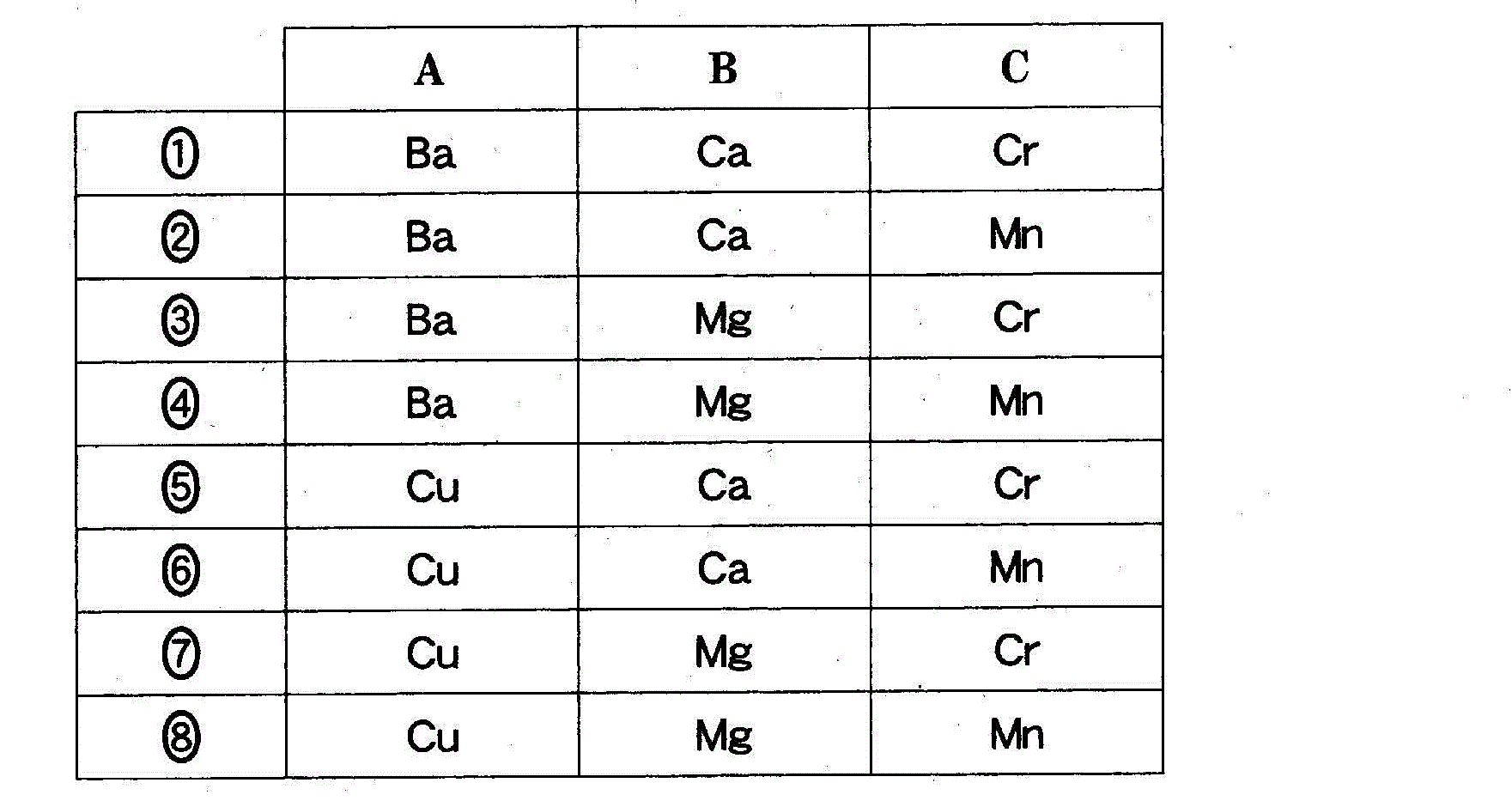
(8)(2010追3_3)

(3)(2010追3_4)


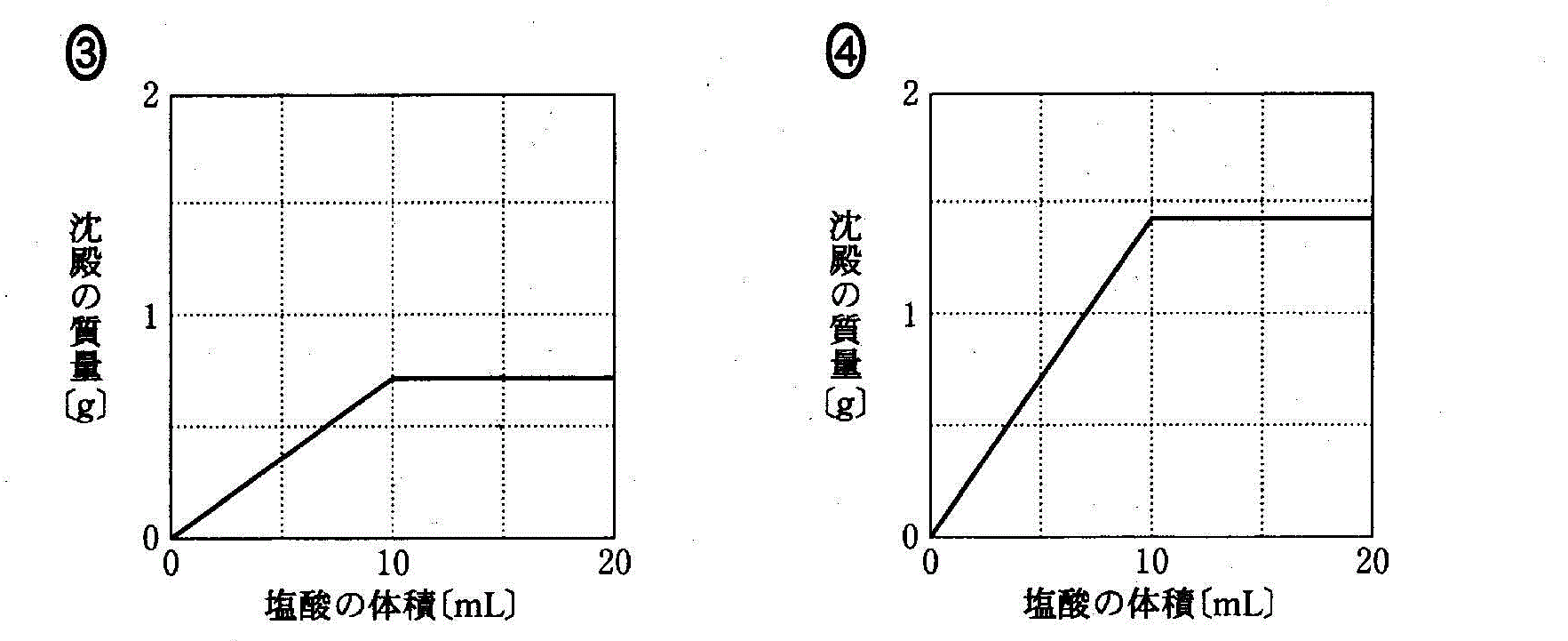
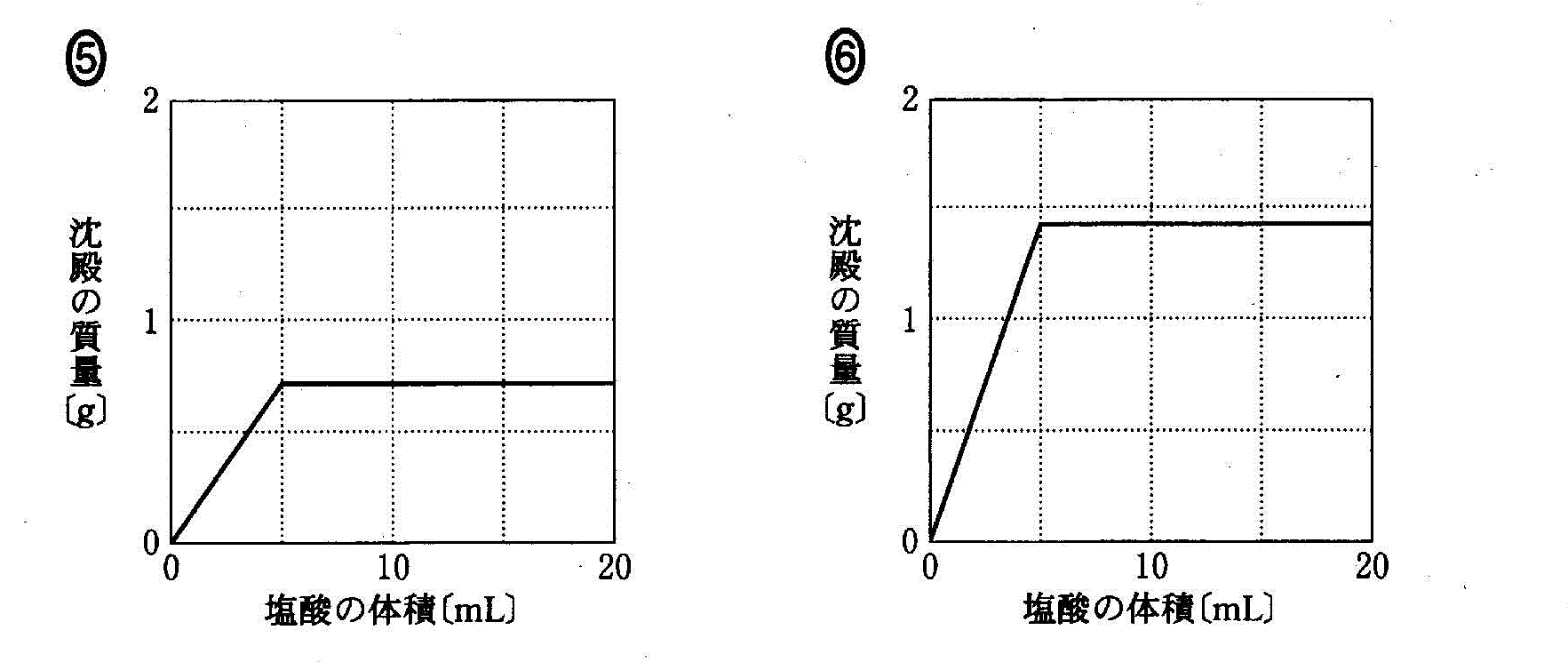
(2)(2010追3_5)

(5)(2010追4_1)

(5)(2010追4_2)

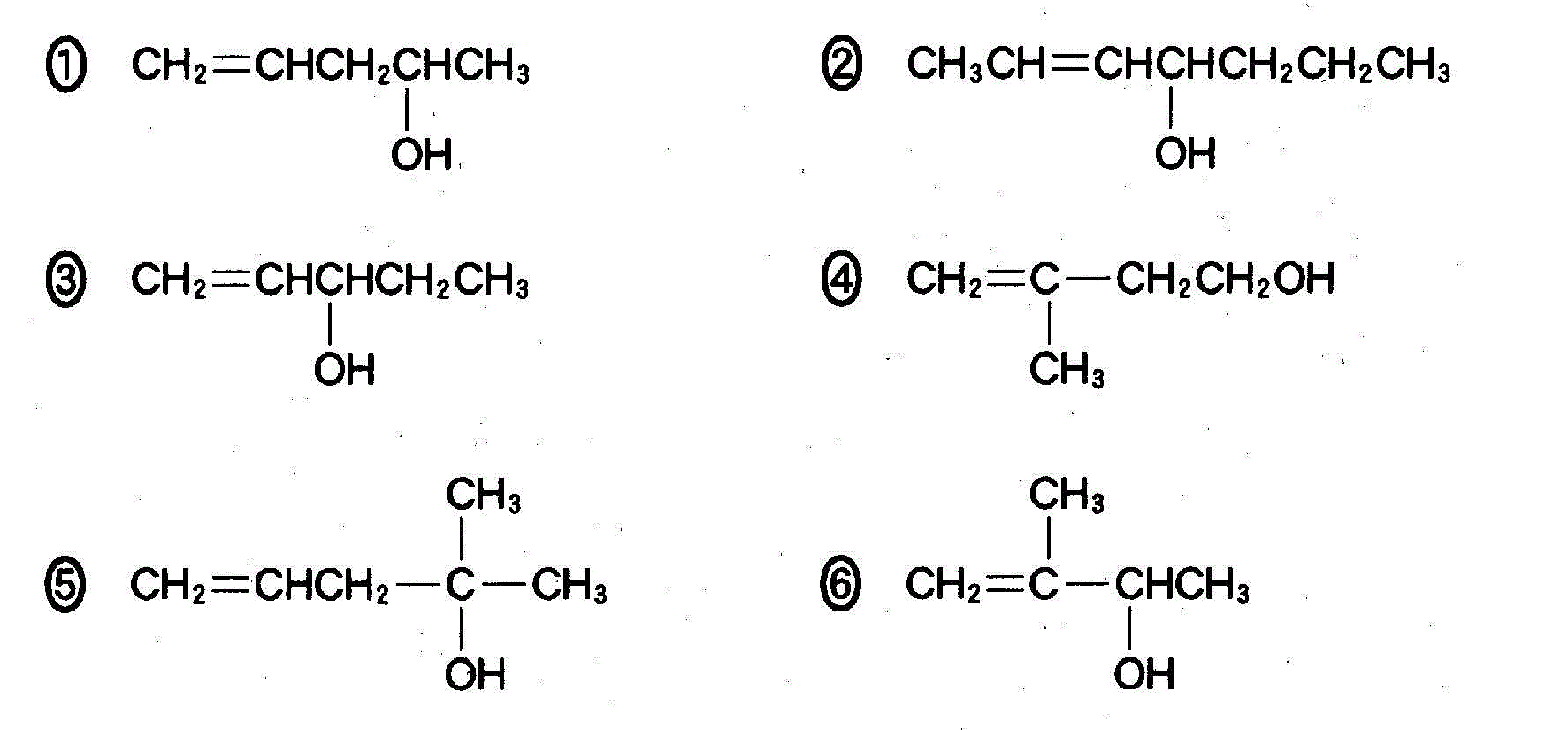
(3)(2010追4_3)
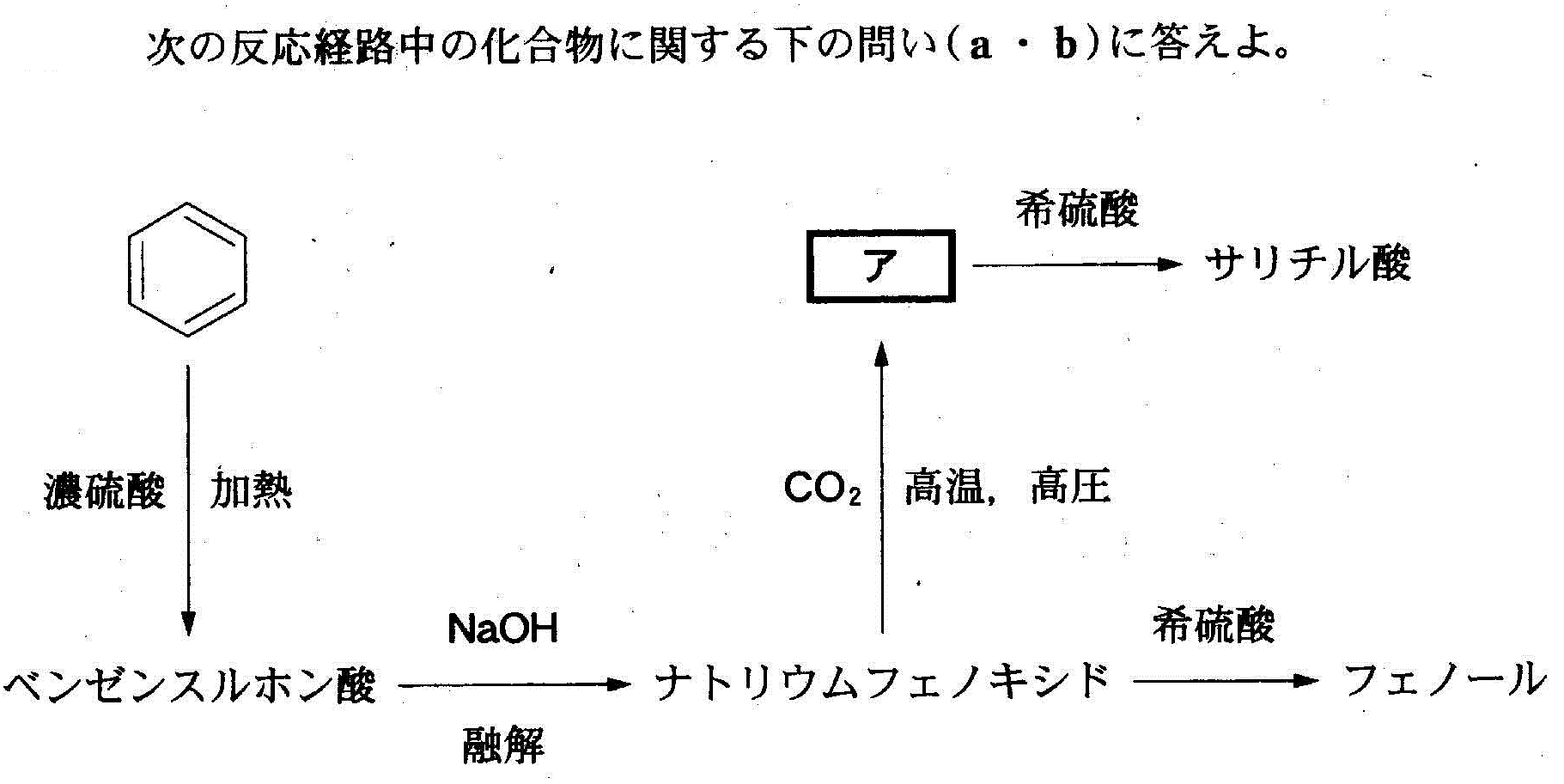
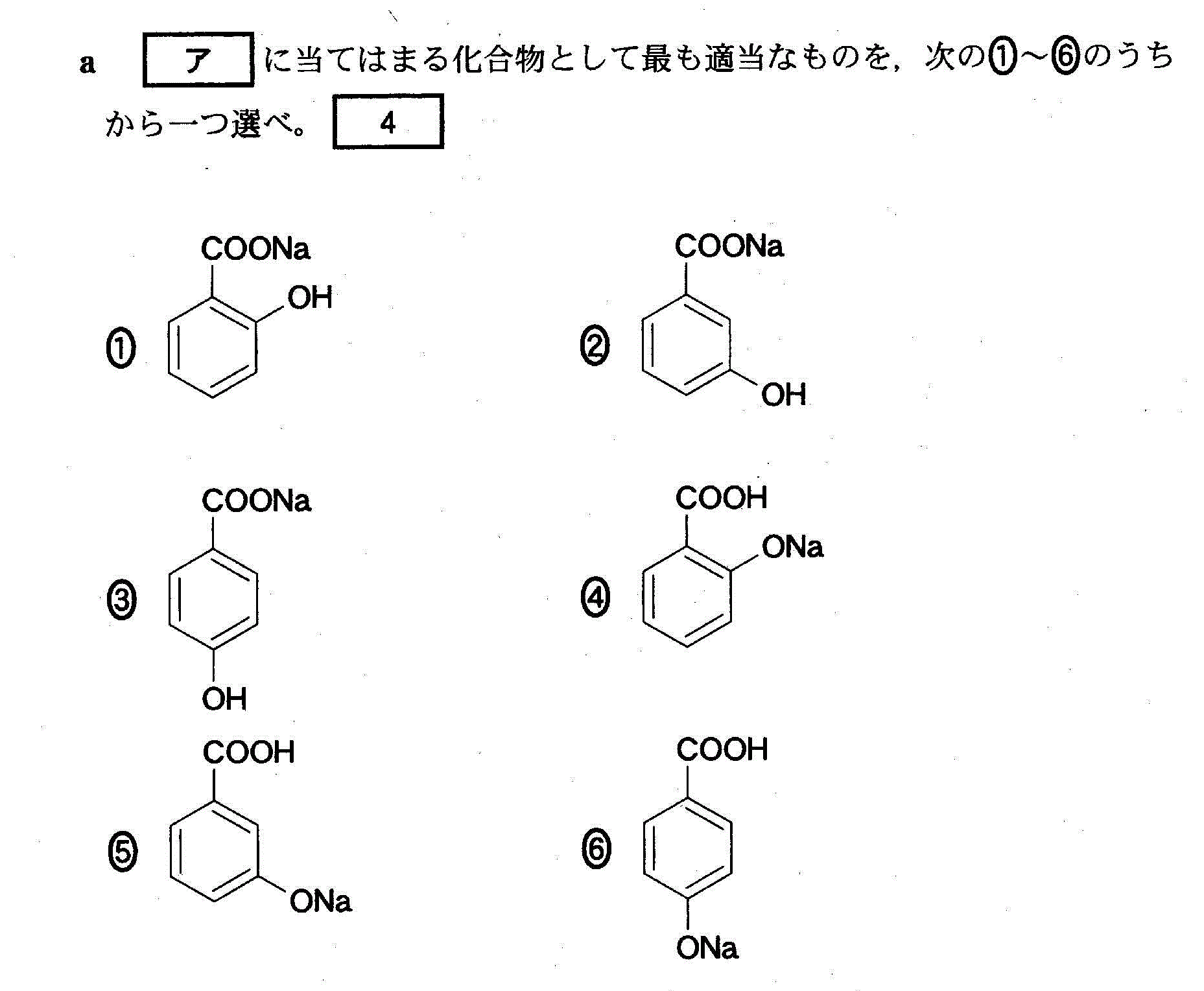

(1)(4)(2010追4_4)
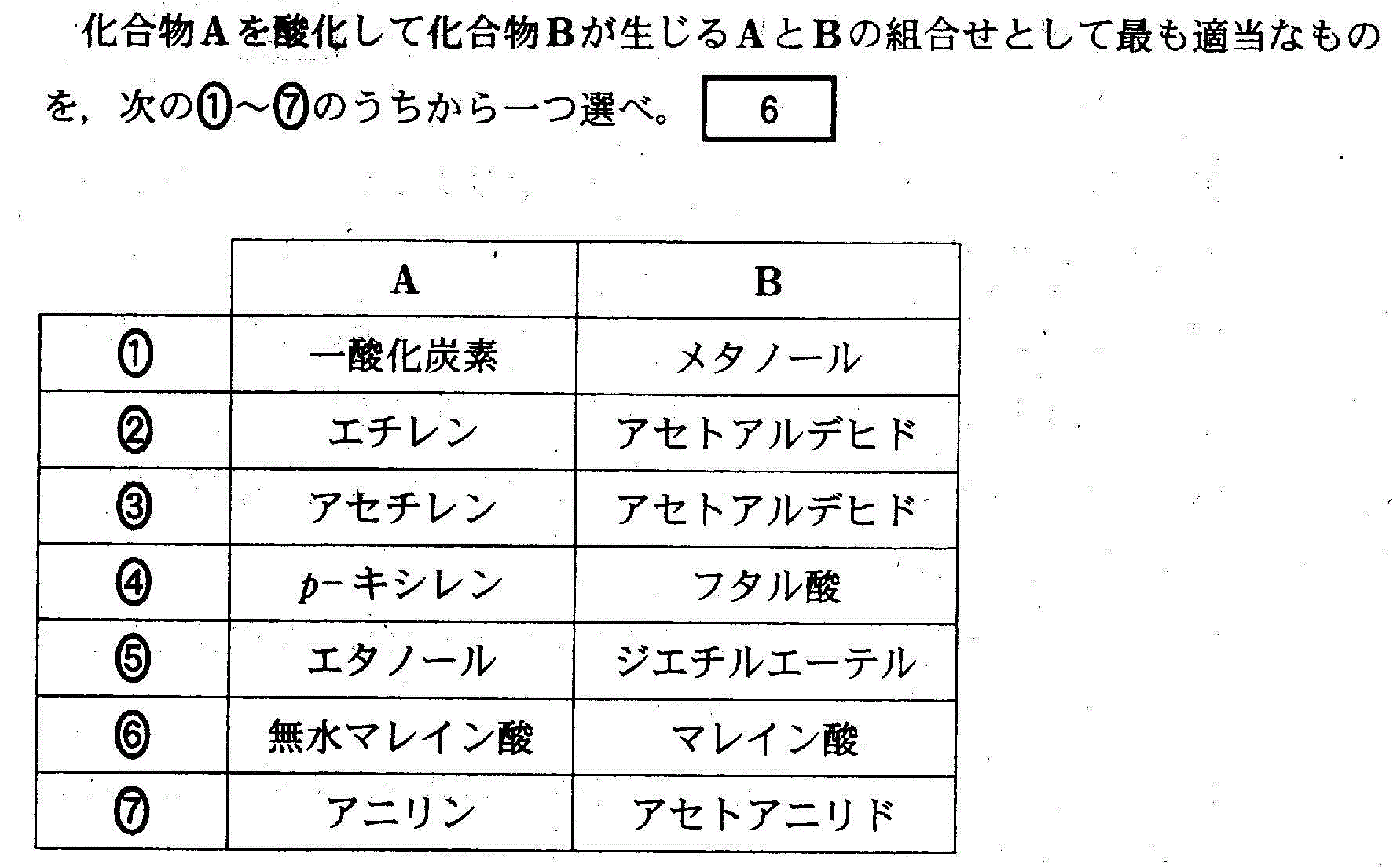
(2)(2010追4_5)
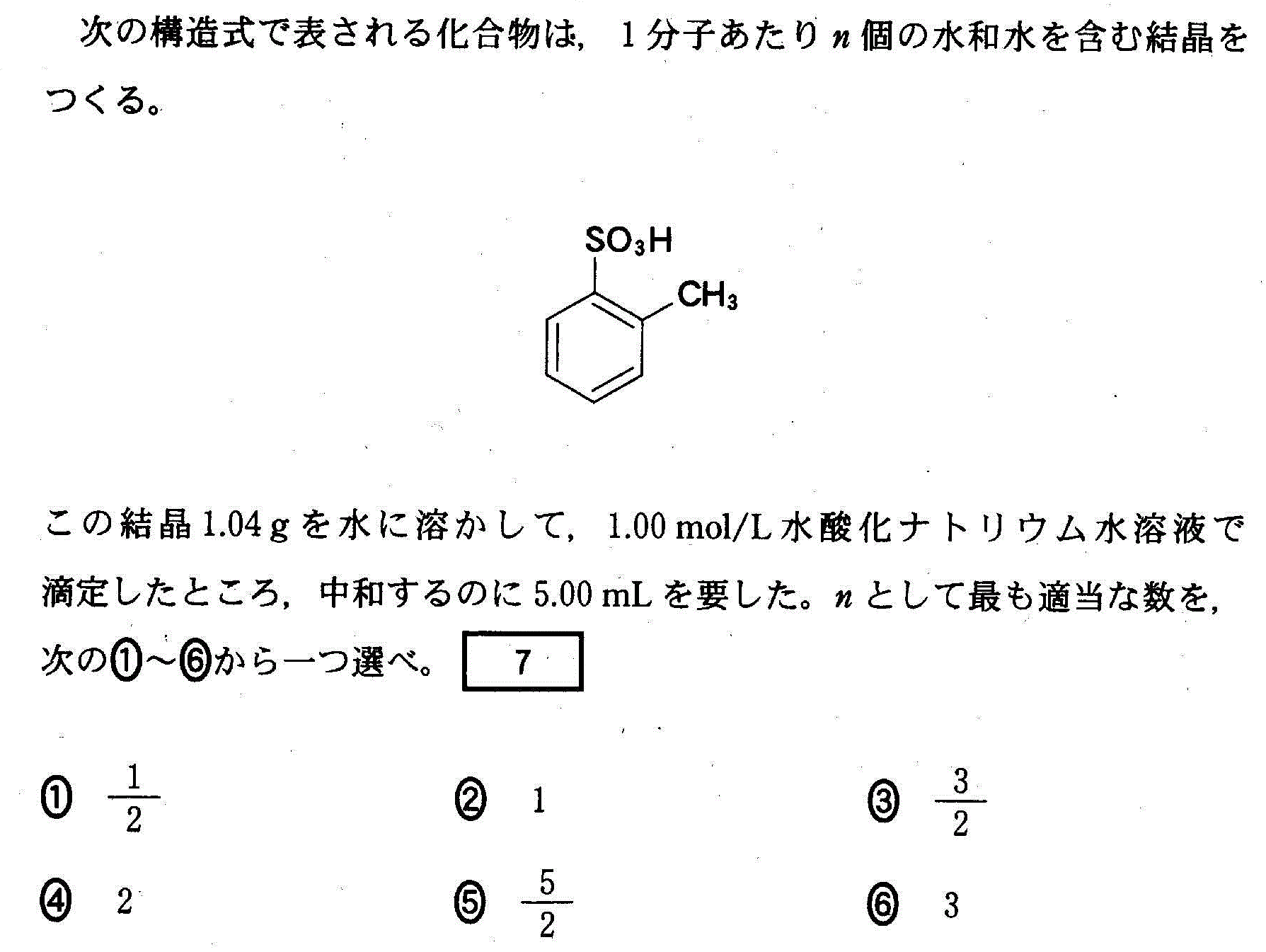
(4)(2010追4_6)
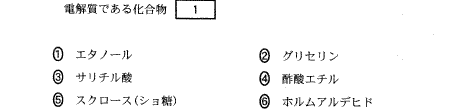
(3)(2011本1_1_a)
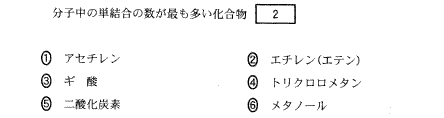
(6)(2011本1_1_b)

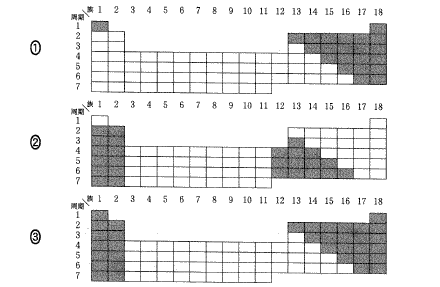
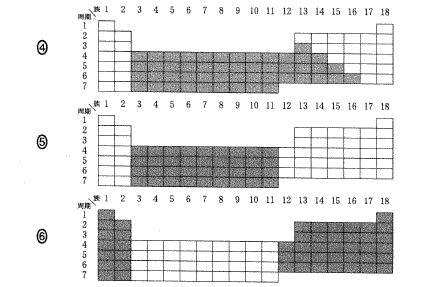
(6)(2011本1_2)



(2)(2011本1_3)

(4)(2011本1_4)
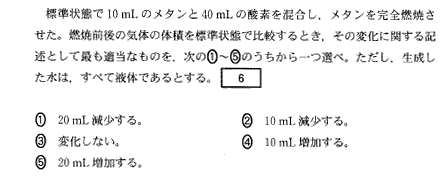
(1)(2011本1_5)

(5)(2011本1_6)
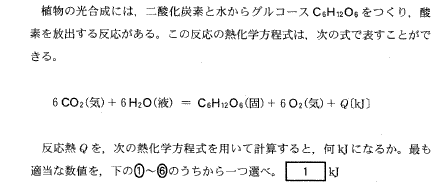
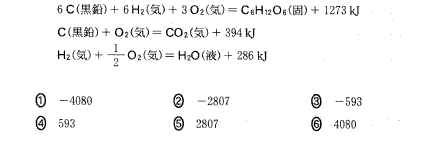
(2)(2011本2_1)

(5)(2011本2_2)
(3)(2011本2_3)
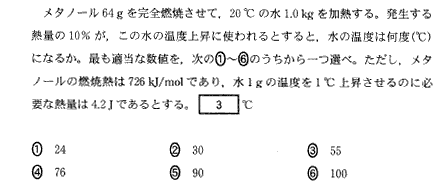
(5)(2011本2_4)



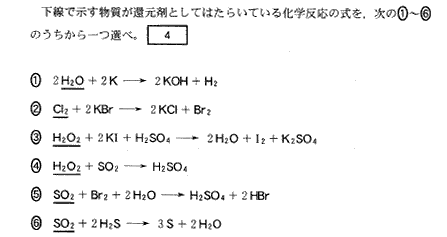
(3)(4)(2011本2_5)

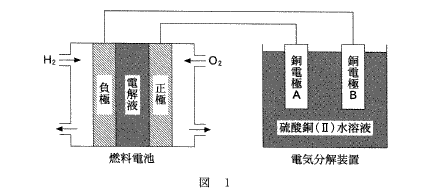
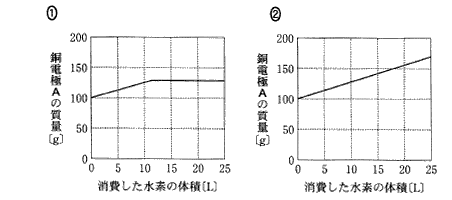
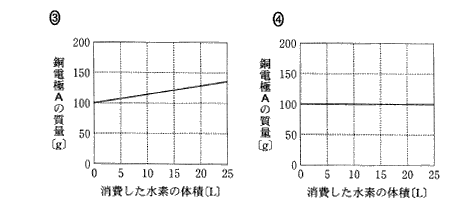
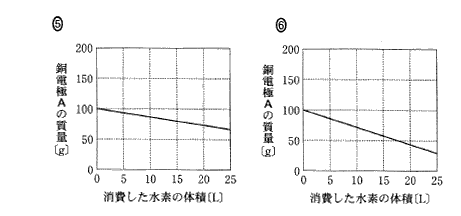
(6)(2011本2_6)

(1)(2011本3_1)

(5)(2011本3_2)

(4)(2011本3_3)

(6)(2011本3_4)

(2)(2011本3_5)
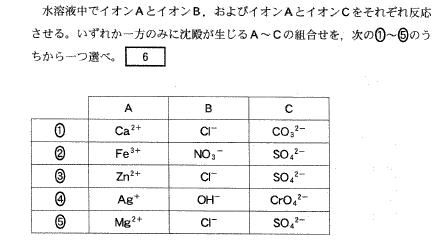
(1)(2011本3_6)

(6)(2011本3_7)

(4)(2011本4_1)

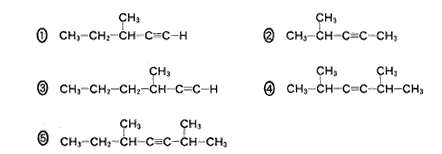
(5)(2011本4_2)

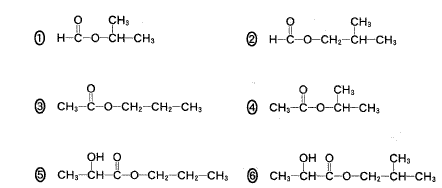
(1)(2011本4_3)
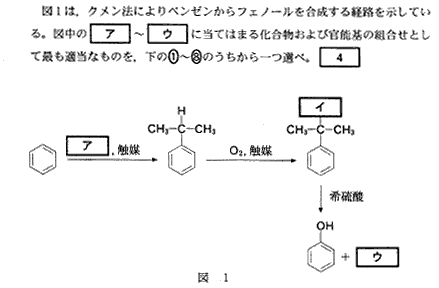
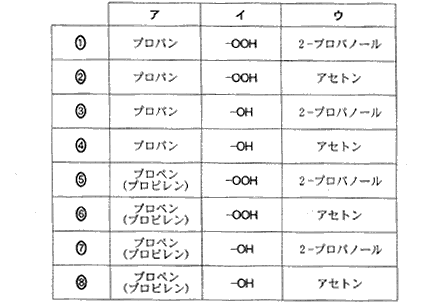
(6)(2011本4_4)




(4)(2)(2011本4_5)

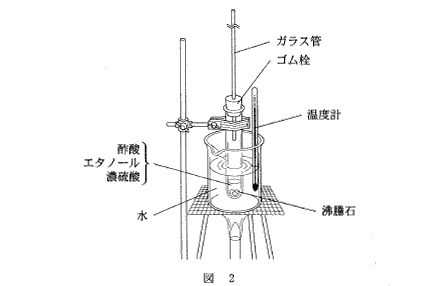
(3)(2011本4_6)
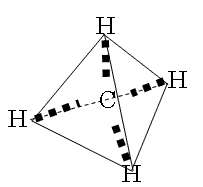
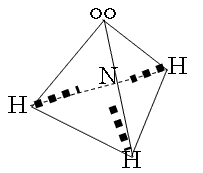
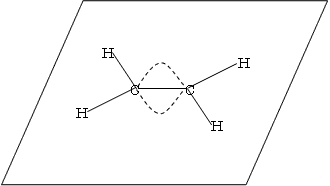
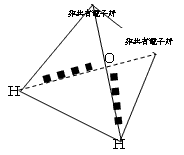

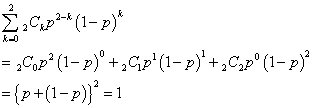
 2×6.02×1021
2×6.02×1021
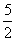 O2(気)
O2(気)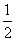 O2(気)
O2(気)
 H++HS-
H++HS-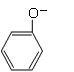 ・・・(エ)
・・・(エ)
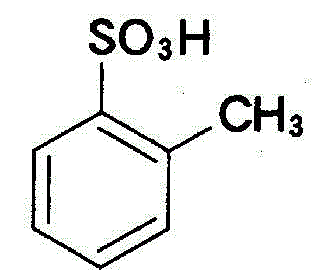 +NaOH→
+NaOH→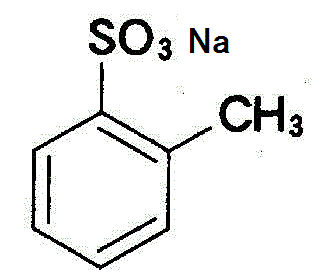 +H2O
+H2O
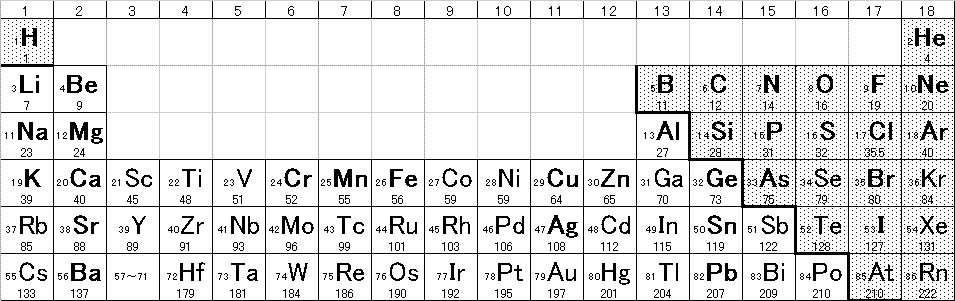
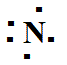
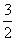 H2O
H2O
 :2分子から脱水して、ジエチルエーテル
:2分子から脱水して、ジエチルエーテル
 CH
CH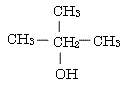 :(第3級アルコール)
:(第3級アルコール)