- 酸・塩基の「強さ」は「電離度」で決まる。
 がほぼ1であるものを「強酸、強塩基」という。
がほぼ1であるものを「強酸、強塩基」という。
- 1価の強酸では、酸の濃度と、それが電離して放出した水素イオンの濃度が等しい。
0.1mol/L の塩酸の水素イオン濃度は 0.1mol/L 、これは 10-1 だから pH は である。
である。
- 2価の強酸では、水素イオンの濃度は酸の濃度の2倍である。
0.1mol/L の硫酸の水素イオン濃度は 0.2mol/L 、これは 2×10-1 だから pH は より小さい。
より小さい。
- 1価の強塩基では、塩基の濃度と、それが電離して放出した水酸化物イオンの濃度が等しい。
0.1mol/L の水酸化ナトリウムの水酸化物イオン濃度は 0.1mol/L 、これは 10-1 、水素イオン濃度は 10-13 だから、pH は である。
である。
- 2価の強塩基では、水酸化物イオンの濃度は塩基の濃度の2倍である。
0.1mol/L の水酸化バリウムの水酸化物イオン濃度は 0.2mol/L 、これは 2×10-1 、水素イオン濃度は 0.5×10-13 だから、 pH は より大きい。
より大きい。
- 1価の強酸では、酸の濃度と、それが電離して放出した水素イオンの濃度が等しい。
 が1よりかなり小さいものを「弱酸、弱塩基」という。
が1よりかなり小さいものを「弱酸、弱塩基」という。
- 1価の弱酸では、酸の濃度に
 をかけたものが、水素イオン濃度になる。
をかけたものが、水素イオン濃度になる。
0.1mol/L の酢酸の電離度を 0.01 とすると、水素イオン濃度は 0.1×0.01mol/L 、これは 10-3 だから pH は である。
である。
- 1価の弱塩基では、塩基の濃度に
 をかけたものが、水酸化物イオン濃度になる。
をかけたものが、水酸化物イオン濃度になる。
0.1mol/L のアンモニア水の電離度を 0.01 とすると、水酸化物イオン濃度は 0.1×0.01mol/L 、これは 10-3 、水素イオン濃度は 10-11 だから pH は である。
である。
- 1価の弱酸では、酸の濃度に
- ところが、中和の等量関係には、酸・塩基の強弱、すなわち「
 」は無関係。
」は無関係。
- 1価の弱酸である酢酸と、2価の強塩基である水酸化カルシウムの中和では、酢酸:水酸化カルシウム =
 :
:  の物質量で中和が完了する。
の物質量で中和が完了する。
- 2価の強酸である硫酸と、1価の弱塩基であるアンモニア水の中和では、硫酸:アンモニア水 =
 :
:  の物質量で中和が完了する。
の物質量で中和が完了する。
- 1価の弱酸である酢酸と、2価の強塩基である水酸化カルシウムの中和では、酢酸:水酸化カルシウム =
- さらに、ところが、中和完了後の水溶液の液性には、酸・塩基の強弱、すなわち「
 」が関係する。
」が関係する。
- 弱酸である酢酸と、強塩基である水酸化カルシウムでは、生じた塩が「弱酸強塩基塩」なので、中和完了点では pH は 7 より
 、
、 性に偏っている。
性に偏っている。
- 強酸である硫酸と、弱塩基であるアンモニア水では、生じた塩が「強酸弱塩基塩」なので、中和完了点では pH は 7 より
 、
、 性に偏っている
性に偏っている
- 弱酸である酢酸と、強塩基である水酸化カルシウムでは、生じた塩が「弱酸強塩基塩」なので、中和完了点では pH は 7 より
(1) 電離度, (2) 1, (3) 13, (4) 3, (5) 11, (6) 2, (7) 1, (8) 1, (9) 2, (10) 大きく, (11) 塩基, (12) 小さく, (13) 酸,
- 鉛蓄電池は、単体の鉛と、酸化鉛(IV)を電極としている。
- 単体の鉛が鉛イオン(II)になるとき、鉛の酸化数は
 から
から に増加する。このとき電子が
に増加する。このとき電子が されるから、鉛は
されるから、鉛は 剤として働いている。鉛が
剤として働いている。鉛が 極となる。
極となる。
鉛1モルが消費されると、 モルの電子が発生する。
モルの電子が発生する。
- 酸化鉛(IV)が鉛イオン(II)になるとき、鉛の酸化数は
 から
から に減少する。このとき電子を
に減少する。このとき電子を から、酸化鉛(IV)は
から、酸化鉛(IV)は 剤として働いている。酸化鉛(IV)が
剤として働いている。酸化鉛(IV)が 極となる。
極となる。
酸化鉛(IV)1モルが消費されるとき、 モルの電子を受け取る。
モルの電子を受け取る。
- 鉛蓄電池の電解液には希硫酸が用いられており、放電時に負極、正極から生じた鉛(II)イオンは、
 と難溶性の塩(沈殿)をつくるから、これが電極に付着し、いずれの電極も質量が
と難溶性の塩(沈殿)をつくるから、これが電極に付着し、いずれの電極も質量が する。
する。
- 負極では、2モルの電子が発生するごとに、単体の鉛1モル(207)が硫酸鉛(II)1モル(207+96)になるので、96グラムの質量が
 する。
する。
- 正極では、2モルの電子を受け取るごとに、酸化鉛(IV)1モル(207+32)が硫酸鉛(II)1モル(207+96)になるので、64グラムの質量が
 する。
する。
- 電解液の希硫酸は、
 が電極に付着して失われるので、濃度が
が電極に付着して失われるので、濃度が なる。
なる。
[問] 鉛蓄電池で、10Aの電流を10時間放電した。正極の質量増加は何グラムか?
[A=C/s]、ファラデー定数96500[C/mol] - 負極では、2モルの電子が発生するごとに、単体の鉛1モル(207)が硫酸鉛(II)1モル(207+96)になるので、96グラムの質量が
(1) 0, (2) +2, (3) 放出, (4) 還元, (5) 負, (6) 2, (7) +4, (8) +2, (9) 受け取る, (10) 酸化, (11) 正, (12) 2, (13) 硫酸イオン, (14) 増加, (15) 小さく,
- 燃料電池は、気体の水素と気体の酸素を電極としている。
- 単体の水素が水になるとき、水素の酸化数は
 から
から に増加する。このとき電子が
に増加する。このとき電子が されるから、水素は
されるから、水素は 剤として働いている。水素が
剤として働いている。水素が 極となる。
極となる。
水素の気体1モルが消費されると、 モルの電子が発生する。
モルの電子が発生する。
- 単体の酸素が水になるとき、酸素の酸化数は
 から
から に減少する。このとき電子を
に減少する。このとき電子を から、酸素は
から、酸素は 剤として働いている。酸素が
剤として働いている。酸素が 極となる。
極となる。
酸素の気体1モルが消費されるとき、 モルの電子を受け取る。
モルの電子を受け取る。
(1) 0, (2) +1, (3) 放出, (4) 還元, (5) 負, (6) 2, (7) 0, (8) -2, (9) 受け取る, (10) 酸化, (11) 正, (12) 4,
- 電池の負極と接続された電極を
 と呼ぶ。
と呼ぶ。 には、電子が流れ込んでくるから、過剰な電子を受け取る反応すなわち、
には、電子が流れ込んでくるから、過剰な電子を受け取る反応すなわち、 反応が起こる。
反応が起こる。
電子を受け取る 剤は、次のように決められる。
剤は、次のように決められる。
- 水溶液中に、水素よりイオン化傾向が小さい金属のイオンがあれば、そのイオンが電子を受け取って
 する。
する。
- なければ、水が電子を受け取って、
 の気体が発生する。
の気体が発生する。
このとき、2モルの電子で1モルの が発生する。
が発生する。
- 水溶液中に、水素よりイオン化傾向が小さい金属のイオンがあれば、そのイオンが電子を受け取って
- 電池の正極と接続された電極を
 と呼ぶ。
と呼ぶ。 では、電子が奪われるから、電子を放出する反応すなわち、
では、電子が奪われるから、電子を放出する反応すなわち、 反応が起こる。
反応が起こる。
電子を放出する 剤は、次のように決められる。
剤は、次のように決められる。
- 電極がPtなどのきわめてイオン化傾向の低い金属であるか、炭素のように反応しにくいものであるとき以外は、電極が溶けて電子を放出する。
- 電極が溶けない(Pt、炭素以外)ときは、水溶液中に塩化物イオンがあればこれが電子を放出して、
 の気体を発生する。
の気体を発生する。
このとき、2モルの電子を放出して1モルの の気体が発生する。
の気体が発生する。
- 電極が溶けない(Pt、炭素以外)で、水溶液中に塩化物イオンがなければ、水の酸素が電子を放出して、
 の気体を発生する。
の気体を発生する。
このとき、4モルの電子を放出して1モルの の気体が発生する。
の気体が発生する。
[問] 硫酸銅水溶液を白金電極で電気分解。10Aの電流を10時間流した。
(1)陰極の質量はどれだけ増えるか?
(2)陽極で発生する気体の標準状態での体積は?
[A=C/s]、ファラデー定数96500[C/mol]、Cu=64
(1)(2)
(1) 陰極, (2) 還元, (3) 酸化, (4) 析出, (5) 水素, (6) 陽極, (7) 塩素, (8) 酸素,
- ハロゲンは周期表の第17族に位置する。
周期表では、希ガスを除き、右上に行くほど「陰性」が強くなる。「陰性」は電子をひきつける性質であるから、「酸化力」に等しい。すべての元素の中で、酸素よりも「陰性」が強いのは のみである。
のみである。
- 常温での状態は、フッ素(
 )、塩素(
)、塩素( )、臭素(
)、臭素( )、ヨウ素(
)、ヨウ素( )である。
)である。
非金属元素の中で常温で液体であるものは、 のみである。
のみである。
また、塩素は の有色の気体である。
の有色の気体である。
- ハロゲンの酸化力は、フッ素、塩素、臭素、ヨウ素の順に弱くなる。
水にフッ素を加えると、 が発生するが、これはフッ素が酸素より「陰性」が強いことを表しており、このような反応を起こすのは、フッ素のみである。
が発生するが、これはフッ素が酸素より「陰性」が強いことを表しており、このような反応を起こすのは、フッ素のみである。
ヨウ化カリウムに塩素を加えると、ヨウ素が発生するが、これは が
が を酸化したためで、逆に塩化カリウムにヨウ素を加えても、なにも起こらない。
を酸化したためで、逆に塩化カリウムにヨウ素を加えても、なにも起こらない。
- ハロゲン化水素は、
 を除いてすべて強酸である。
を除いてすべて強酸である。 は弱酸であるが、ガラスを溶かすという特徴をもつ。
は弱酸であるが、ガラスを溶かすという特徴をもつ。
(1) フッ素, (2) 気体, (3) 液体, (4) 固体, (5) 臭素, (6) 黄緑色, (7) 酸素, (8) 塩素, (9) ヨウ化物イオン, (10) フッ化水素,
 のイオンは、一切沈殿しない。
のイオンは、一切沈殿しない。
 のイオンが沈殿を生じるのは、
のイオンが沈殿を生じるのは、 、
、 のみである。
のみである。
 、
、 以外のすべての金属イオンは、
以外のすべての金属イオンは、 で沈殿を生じる。
で沈殿を生じる。
- 金属の水酸化物は、
 と呼ばれるが、このうち水に溶けて塩基性を示すのは、
と呼ばれるが、このうち水に溶けて塩基性を示すのは、 、
、 の水酸化物のみである。他は水には溶けないが、
の水酸化物のみである。他は水には溶けないが、 と反応する。したがって、すべての金属イオンの
と反応する。したがって、すべての金属イオンの による沈殿は、
による沈殿は、 によって溶ける。
によって溶ける。
 の水酸化物は
の水酸化物は であるから、
であるから、 ・
・ 両方の働きを持つ。
両方の働きを持つ。
したがって、 の
の による沈殿に、過剰な
による沈殿に、過剰な を加えると、反応して沈殿が溶ける。
を加えると、反応して沈殿が溶ける。
 、
、 、
、 のイオンは、アンモニア分子を取り込んで水に可溶性の「錯イオン」を作る。したがって、これらのイオンの
のイオンは、アンモニア分子を取り込んで水に可溶性の「錯イオン」を作る。したがって、これらのイオンの による沈殿に、過剰な
による沈殿に、過剰な 水を加えると、沈殿が溶ける。
水を加えると、沈殿が溶ける。
- 硫化水素は、水に溶けて弱酸性を示す気体である。
- 酸性の水溶液に硫化水素の気体を吹き込むと、水溶液中にはすでに水素イオンが十分存在しているから、硫化水素の電離は妨げられ、硫化物イオンの濃度は
 抑えられる。
抑えられる。
このような状態でも、硫化物イオンとの沈殿を生じるのは、 、
、 、
、 のイオンだけである。
のイオンだけである。
- 塩基性の水溶液に硫化水素の気体を吹き込むと、水溶液中の水酸化物イオンとの間に中和反応が起こり、硫化水素の電離は促進され、硫化物イオンの濃度は
 なる。
なる。
この状態では、 、
、 、
、 のイオンにくわえて、
のイオンにくわえて、 、
、 のイオンも硫化物イオンとの沈殿を作り始める。
のイオンも硫化物イオンとの沈殿を作り始める。
- また、硫化水素には
 力があるので、
力があるので、 イオンは、
イオンは、 イオンに
イオンに されてから沈殿する。
されてから沈殿する。
- 酸性の水溶液に硫化水素の気体を吹き込むと、水溶液中にはすでに水素イオンが十分存在しているから、硫化水素の電離は妨げられ、硫化物イオンの濃度は
- 塩化物イオンで沈殿を生じるのは、
 のイオンと、
のイオンと、 のイオンのみである。
のイオンのみである。
- 硫酸イオンで沈殿を生じるのは、
 のイオンと、
のイオンと、 のイオンのみである。
のイオンのみである。
- 一般に有色の沈殿を作るのは、
 のイオンであり、それ以外は白色であることが多い。
のイオンであり、それ以外は白色であることが多い。
ただし、硫化物イオンによる沈殿は、ほとんどが黒色で、 イオンとの沈殿のみが例外的に白色である。
イオンとの沈殿のみが例外的に白色である。
(1) アルカリ金属, (2) アルカリ土類金属, (3) 炭酸イオン, (4) 硫酸イオン, (5) 水酸化物イオン, (6) 塩基性水酸化物, (7) 酸, (8) 両性元素, (9) 両性水酸化物, (10) 塩基, (11) 水酸化ナトリウム, (12) 亜鉛, (13) 銀, (14) 銅, (15) アンモニア, (16) 低く, (17) 鉛, (18) 銅, (19) 銀, (20) 高く, (21) 亜鉛, (22) 鉄(II), (23) 還元, (24) 鉄(III), (25) 遷移元素,
- イオン化傾向が水素より大きい金属の単体に、希
 、希
、希 などの電離度の大きい酸を加えると、水素の気体が発生する。
などの電離度の大きい酸を加えると、水素の気体が発生する。
このとき、酸の電離によって生じた が電子を
が電子を いるので、
いるので、 の役割、金属が電子を
の役割、金属が電子を 、陽イオンになっているので、
、陽イオンになっているので、 の役割を果たしている。
の役割を果たしている。
例外は で、生じた
で、生じた の陽イオンが
の陽イオンが 、
、 に含まれる
に含まれる 、
、 と難溶性の塩(沈殿)をつくってしまうからである。
と難溶性の塩(沈殿)をつくってしまうからである。
- 特にイオン化傾向が大きい金属
 、
、 、
、 の単体は、常温で水と反応して水素を発生させる。
の単体は、常温で水と反応して水素を発生させる。
水の水素の酸化数は であるから、このときは水が
であるから、このときは水が の役割を果たしている。
の役割を果たしている。
この反応は爆発的に起こるので危険であるから、これらの金属の単体は の中で保存する。
の中で保存する。
 の単体は、酸だけではなく、
の単体は、酸だけではなく、 とも反応して水素を発生させる。
とも反応して水素を発生させる。
(1) 塩酸, (2) 硫酸, (3) 水素イオン, (4) 受け取って, (5) 酸化剤, (6) 放出して, (7) 還元剤, (8) 鉛, (9) 塩化物イオン, (10) 硫酸イオン, (11) カリウム, (12) カルシウム, (13) ナトリウム, (14) +1, (15) 石油 , (16) 両性元素 , (17) 塩基 ,
 水に
水に を加えると、酸素の気体が発生する。
を加えると、酸素の気体が発生する。
 の酸素の酸化数は
の酸素の酸化数は であるから、酸化数 0 の酸素の単体になるときは
であるから、酸化数 0 の酸素の単体になるときは として働き、酸化数 -2 の水になるときは
として働き、酸化数 -2 の水になるときは として働くことができる。だから、この反応では、
として働くことができる。だから、この反応では、 は酸化還元反応を行っておらず、
は酸化還元反応を行っておらず、 として作用している。
として作用している。
- 水に
 の気体を加えると、酸素の気体が発生する。
の気体を加えると、酸素の気体が発生する。
この反応では、水に含まれていた酸化数 -2 の酸素が、酸化数 0 の酸素の単体に変わったのだから、酸素が されている。
されている。
周期表の中で、希ガス元素を除き、右上に行くほど が大きくなり、「陰性」が強くなる。「陰性」とは電子を
が大きくなり、「陰性」が強くなる。「陰性」とは電子を 性質であり、
性質であり、 力を意味する。
力を意味する。
酸素よりも、「陰性」が、したがって 力が強い元素は、
力が強い元素は、 しかない。だから、このような反応を起こす元素は、
しかない。だから、このような反応を起こす元素は、 だけである。
だけである。
(1) 過酸化水素, (2) 酸化マンガン(IV), (3) -1, (4) 還元剤, (5) , 酸化剤;(6) 触媒, (7) フッ素, (8) 酸化, (9) 電子親和力, (10) 引き付ける,
 に
に を加えると、塩素の気体が発生する。
を加えると、塩素の気体が発生する。
 の塩素の酸化数は
の塩素の酸化数は であるから、酸化数 0 の塩素の単体になるときに
であるから、酸化数 0 の塩素の単体になるときに として働いている。したがって、ここでは
として働いている。したがって、ここでは は
は として作用している。
として作用している。
 、
、 など、次亜塩素酸イオンを含む物質は、「漂白剤」、「消毒剤」として利用されている。
など、次亜塩素酸イオンを含む物質は、「漂白剤」、「消毒剤」として利用されている。
次亜塩素酸イオンの塩素の酸化数は、 であり、これが酸化数 -1 の塩化物イオンに変化するとき、
であり、これが酸化数 -1 の塩化物イオンに変化するとき、 力を発揮するからである。
力を発揮するからである。
ところが、次亜塩素酸イオンに、 など、塩化物イオンを含むものを加えると、塩素の単体が発生してしまい、大変危険である。
など、塩化物イオンを含むものを加えると、塩素の単体が発生してしまい、大変危険である。
- 塩素は、刺激臭のある有毒な気体で、
 色の有色の気体である。水に溶けると
色の有色の気体である。水に溶けると と
と を生じるから、塩素の気体を乾燥させるにはソーダ石灰など塩基性の乾燥剤は用いることができず、
を生じるから、塩素の気体を乾燥させるにはソーダ石灰など塩基性の乾燥剤は用いることができず、 を用いる。
を用いる。
(1) 塩酸, (2) 酸化マンガン(IV), (3) -1, (4) 還元剤, (5) 酸化剤, (6) さらし粉, (7) 次亜塩素酸ナトリウム, (8) +1, (9) 酸化, (10) 塩酸, (11) 黄緑, (12) 塩酸, (13) 次亜塩素酸, (14) 濃硫酸,
- 食塩水に
 を加えて加熱すると、
を加えて加熱すると、 の気体が発生する。これは、
の気体が発生する。これは、 の
の という性質を利用している。
という性質を利用している。
 の水溶液を
の水溶液を と呼んでいる。
と呼んでいる。
(1) 濃硫酸, (2) 塩化水素, (3) 不揮発性, (4) 塩酸,
- 硫化水素は、常温で気体であり、水に溶け弱酸性を示す。したがって、硫化水素を得るには、
 など、弱酸である硫化水素の塩に、希
など、弱酸である硫化水素の塩に、希 、希
、希 などの強酸を作用させればよい。
などの強酸を作用させればよい。
- 硫化水素は、弱酸性の気体であるから、酸性の水溶液に吹き込むと、電離が抑制され硫化物イオンはわずかしか発生しない。したがって、硫化水素を吹き込んだ酸性水溶液中で沈殿するのは、
 、
、 、
、 など、非常に沈殿しやすい金属の陽イオンに限られている。
など、非常に沈殿しやすい金属の陽イオンに限られている。
反対に、塩基性の水溶液に、硫化水素を吹き込むと、中和が進行して電離が促進され、硫化物イオンの濃度は高まる。したがって、硫化水素を吹き込んだ塩基性水溶液では、 、
、 、
、 のイオンに加えて、
のイオンに加えて、 イオン、
イオン、 イオンも沈殿する。
イオンも沈殿する。
なお、硫化水素の硫黄の酸化数は であり、強い
であり、強い 力をもっている。このため、
力をもっている。このため、 イオンは
イオンは イオンに還元されてから、沈殿する。
イオンに還元されてから、沈殿する。
- 硫化水素は、
 臭の、毒性の強い気体である。
臭の、毒性の強い気体である。
この気体を乾燥するには、酸性であることから、 など、塩基性の乾燥剤は使用できず、また、強い
など、塩基性の乾燥剤は使用できず、また、強い 力を持つことから、強力な酸化剤である
力を持つことから、強力な酸化剤である で乾燥することもできないので、塩化カルシウムなど中性の乾燥剤を用いなければならない。。
で乾燥することもできないので、塩化カルシウムなど中性の乾燥剤を用いなければならない。。
(1) 硫化鉄, (2) 塩酸, (3) 硫酸, (4) 鉛, (5) 銅, (6) 銀, (7) 亜鉛, (8) 鉄(II), (9) -2, (10) 還元, (11) 鉄(III), (12) 腐卵, (13) ソーダ石灰, (14) 濃硫酸,
- アンモニアは、水によく溶けて弱
 を示す気体である。弱塩基の塩に強塩基を作用させると、弱塩基が発生することを利用して、得ることができる。
を示す気体である。弱塩基の塩に強塩基を作用させると、弱塩基が発生することを利用して、得ることができる。
アンモニアの塩である に、
に、 などの強塩基を作用させると、アンモニアの気体が発生する。
などの強塩基を作用させると、アンモニアの気体が発生する。
- 工業的には、窒素の気体と水素の気体から直接アンモニアを合成する「
 」が用いられている。
」が用いられている。
- アンモニアは、水に溶けやすく、空気より
 気体であるから、捕集法としては、
気体であるから、捕集法としては、 を用い、乾燥するときは
を用い、乾燥するときは の気体であることから、酸性を示す
の気体であることから、酸性を示す は用いることができないので、塩基性の
は用いることができないので、塩基性の などを用いる。
などを用いる。
(1) 塩基性, (2) 塩化アンモニウム, (3) 水酸化ナトリウム, (4) ハーバー・ボッシュ法, (5) 軽い, (6) 上方置換, (7) 濃硫酸, (8) ソーダ石灰,
- 非金属の酸化物は
 と呼ばれる。水に溶けて酸性を示したり、塩基と反応したりするからである。
と呼ばれる。水に溶けて酸性を示したり、塩基と反応したりするからである。
- 非金属酸化物の多くは常温で気体であるが、固体であるものとして、
 の酸化物、
の酸化物、 の酸化物などがある。
の酸化物などがある。
 の酸化物の
の酸化物の は、共有結合結晶の硬い固体でありガラスの主原料である。反応しにくい物質であるが、弱酸である
は、共有結合結晶の硬い固体でありガラスの主原料である。反応しにくい物質であるが、弱酸である には溶ける。また、
には溶ける。また、 であるから、強い塩基にはわずかに反応するので、水酸化ナトリウムを保存する際にはガラス栓を用いるとガラスがわずかに溶けて、くっついてしまうので、ゴム栓を用いなければならない。
であるから、強い塩基にはわずかに反応するので、水酸化ナトリウムを保存する際にはガラス栓を用いるとガラスがわずかに溶けて、くっついてしまうので、ゴム栓を用いなければならない。
リンの酸化物(十酸化四リン)には、空気中の水分を吸収して結晶が崩壊する がある。
がある。
- 気体である非金属酸化物のうち、
 、
、 は水に溶けて弱酸性を示し、それぞれ「炭酸」、「亜硫酸」と呼ばれる。
は水に溶けて弱酸性を示し、それぞれ「炭酸」、「亜硫酸」と呼ばれる。
 は刺激臭の有毒な気体で、
は刺激臭の有毒な気体で、 のおもな原因物質である。
のおもな原因物質である。
また、 は水と反応して硝酸となり、強酸性を示す。
は水と反応して硝酸となり、強酸性を示す。 は、刺激臭の有毒な気体で、
は、刺激臭の有毒な気体で、 色の有色の気体であることが特徴である。
色の有色の気体であることが特徴である。
これに対して、 、
、 は水に溶けない。
は水に溶けない。
 は
は されて、
されて、 になる際、
になる際、 力を示すので、製鉄所の
力を示すので、製鉄所の で、鉄鉱石を
で、鉄鉱石を まで
まで するとき、
するとき、 剤として用いられる。
剤として用いられる。
- 濃硫酸は強力な酸化剤で、自らは
 されて、
されて、 となる。このとき硫黄の酸化数は
となる。このとき硫黄の酸化数は から
から へと変化している。
へと変化している。
希硝酸、濃硝酸はともに強力な酸化剤であるが、希硝酸は されて、
されて、 となり、濃硝酸は
となり、濃硝酸は されて、
されて、 となる。
となる。
希硝酸から への反応では、窒素の酸化数は
への反応では、窒素の酸化数は から
から へ、濃硝酸から
へ、濃硝酸から への反応では、窒素の酸化数は
への反応では、窒素の酸化数は から
から へと変化している。
へと変化している。
イオン化傾向が銀よりも大きな金属の単体は、これらの強力な酸化剤に溶ける。ただし、 、
、 は例外で、
は例外で、 と呼ばれる強力な酸化皮膜を形成するので、反応が進行しない。
と呼ばれる強力な酸化皮膜を形成するので、反応が進行しない。
(1) 酸性酸化物, (2) ケイ素, (3) リン, (4) 二酸化ケイ素, (5) フッ化水素, (6) 潮解性, (7) 二酸化炭素, (8) 二酸化硫黄, (9) 酸性雨, (10) 二酸化窒素, (11) 赤褐色, (12) 一酸化炭素, (13) 一酸化窒素, (14) 酸化, (15) 還元, (16) 高炉, (17) 銑鉄, (18) 還元, (19) +6, (20) +4, (21) +5, (22) +2, (23) +4, (24) アルミニウム, (25) 鉄, (26) 不動態,
- 石灰岩(
 )に希
)に希 、希
、希 などの強酸を加えると、二酸化炭素の気体が発生する。弱酸の塩に強酸を加えたら、弱酸が発生した、と説明できる。
などの強酸を加えると、二酸化炭素の気体が発生する。弱酸の塩に強酸を加えたら、弱酸が発生した、と説明できる。
CaCO3 + 2HCl → CaO + CO2
このとき同時に発生する は、金属の酸化物であるから、
は、金属の酸化物であるから、 である。
である。 のうち、アルカリ金属とアルカリ土類金属の酸化物だけは水に溶け、いずれも強塩基性を示す。カルシウムもアルカリ土類金属であるから、
のうち、アルカリ金属とアルカリ土類金属の酸化物だけは水に溶け、いずれも強塩基性を示す。カルシウムもアルカリ土類金属であるから、 も水によく溶け、強塩基である
も水によく溶け、強塩基である を発生する。この反応は、
を発生する。この反応は、 の工業的製法である「アンモニア・ソーダ法」でも用いられている。
の工業的製法である「アンモニア・ソーダ法」でも用いられている。
- 「固体の弱酸の塩に液体の強酸を加えたら、弱酸の気体が発生する」のであるから、二酸化炭素は、上の方法に限らず、例えばナトリウムの炭酸塩、
 、
、 に希塩酸や希硫酸を加えることでも得られる。
に希塩酸や希硫酸を加えることでも得られる。
 を加熱分解すると、気体の二酸化炭素、液体の
を加熱分解すると、気体の二酸化炭素、液体の 、固体の
、固体の になる。この反応も「アンモニア・ソーダ法」で用いられている。
になる。この反応も「アンモニア・ソーダ法」で用いられている。
(1) 炭酸カルシウム, (2) 塩酸, (3) 硫酸, (4) 酸化カルシウム, (5) 塩基性酸化物, (6) 水酸化カルシウム, (7) 炭酸ナトリウム, (8) 炭酸水素ナトリウム, (9) 水,
 、
、 など、水素よりもイオン化傾向が小さい金属は、希塩酸や希硫酸などの強酸と反応して
など、水素よりもイオン化傾向が小さい金属は、希塩酸や希硫酸などの強酸と反応して を発生することはないが、
を発生することはないが、 、
、 、
、 などの強力な酸化剤には溶ける。
などの強力な酸化剤には溶ける。
濃硫酸が酸化剤として働くとき、 が発生する。
が発生する。
- 二酸化硫黄は、水に溶けると「亜硫酸」と呼ばれ弱酸性を示す気体であるから、例えば
 、亜硫酸水素ナトリウムなどの塩に、強酸を作用させることでも得られる。
、亜硫酸水素ナトリウムなどの塩に、強酸を作用させることでも得られる。
(1) 銅, (2) 銀, (3) 水素, (4) 濃硫酸, (5) 希硝酸, (6) 濃硝酸, (7) 二酸化硫黄, (8) 亜硫酸ナトリウム,
 、
、 などの金属に、酸化剤として
などの金属に、酸化剤として を作用させると、気体の一酸化窒素が発生する。一酸化窒素は
を作用させると、気体の一酸化窒素が発生する。一酸化窒素は 色の水に溶けない気体である。
色の水に溶けない気体である。
 、
、 などの金属に、酸化剤として
などの金属に、酸化剤として を作用させると、気体の二酸化窒素が発生する。二酸化窒素は
を作用させると、気体の二酸化窒素が発生する。二酸化窒素は 色の気体で、水と反応して強酸性を示す。
色の気体で、水と反応して強酸性を示す。
(1) 銅, (2) 銀, (3) 希硝酸, (4) 無, (5) 濃硝酸, (6) 赤褐,
- 単体の硫黄や黄鉄鉱などを原料に、これを順次
 して、
して、 、
、 として、これを水に溶かして硫酸を得る。
として、これを水に溶かして硫酸を得る。
単体の硫黄、 、
、 、硫酸の硫黄(S)の酸化数は、順に
、硫酸の硫黄(S)の酸化数は、順に →
→ →
→ →
→ となる。
となる。
- 原料である硫黄1モルから、製品である硫酸
 モルが得られる。
モルが得られる。
[問] 1kgの硫黄から得られる98%の濃硫酸の質量[kg]を求めよ。 - 濃硫酸が水に溶けるとき、大量の
 が発生する。大量の濃硫酸に少量の水を加えると、急速に気化した熱湯の滴が跳ね飛ばされて危険であるから、逆に大量の
が発生する。大量の濃硫酸に少量の水を加えると、急速に気化した熱湯の滴が跳ね飛ばされて危険であるから、逆に大量の に
に を少しずつ加える。
を少しずつ加える。
- 希硫酸は電離度の高い
 であるが、濃硫酸の電離度は低い。
であるが、濃硫酸の電離度は低い。
濃硫酸には、以下のような重要な性質がある。- 強力な
 であり、銅、銀などイオン化傾向の低い金属も溶かして、
であり、銅、銀などイオン化傾向の低い金属も溶かして、 の気体を発生する。
の気体を発生する。
- 「エステル化」などの際に見られるように
 性を持つ。この性質から、気体の乾燥剤としても用いられている。
性を持つ。この性質から、気体の乾燥剤としても用いられている。
- 沸点が高く、
 である。この性質を利用して
である。この性質を利用して に濃硫酸を加えて加熱することにより、
に濃硫酸を加えて加熱することにより、 を発生させることができる。
を発生させることができる。
- 強力な
(1) 酸化, (2) 二酸化硫黄, (3) 三酸化硫黄, (4) 0, (5) +4, (6) +6, (7) +6, (8) 1, (9) 溶解熱, (10) 水, (11) 硫酸, (12) 強酸, (13) 酸化剤, (14) 二酸化硫黄, (15) 脱水, (16) 不揮発性, (17) 塩化ナトリウム(食塩), (18) 塩化水素,
 によって製造された気体のアンモニアを原料に、これを順次
によって製造された気体のアンモニアを原料に、これを順次 して、
して、 、
、 とし、これを水と反応させて硝酸を得る。
とし、これを水と反応させて硝酸を得る。
アンモニア、 、
、 、硝酸の窒素(N)の酸化数は、順に
、硝酸の窒素(N)の酸化数は、順に →
→ →
→ →
→ となる。
となる。
- 原料であるアンモニア1モルから、製品である硝酸
 モルが得られる。
モルが得られる。
[問] 標準状態で10Lの気体のアンモニアから得られる63%の濃硝酸の質量[kg]を求めよ。 - 希硝酸は電離度の高い
 であるが、濃硝酸の電離度は低い。
であるが、濃硝酸の電離度は低い。
希硝酸も濃硝酸も強力な であり、銅、銀などのイオン化傾向の低い金属も溶かす。
であり、銅、銀などのイオン化傾向の低い金属も溶かす。
このとき、希硝酸は 、濃硝酸は
、濃硝酸は の気体をそれぞれ発生する。
の気体をそれぞれ発生する。
(1) ハーバー・ボッシュ法, (2) 酸化, (3) 一酸化窒素, (4) 二酸化窒素, (5) -3, (6) +2, (7) +4, (8) +5, (9) 1, (10) 強酸, (11) 酸化剤, (12) 一酸化窒素, (13) 二酸化窒素,
- 「アンモニア・ソーダ法」は、工業的に
 を製造する方法である。
を製造する方法である。 はガラスの製造工程で、主成分の
はガラスの製造工程で、主成分の に混ぜて用いられる。
に混ぜて用いられる。
- 飽和
 水に、気体の
水に、気体の と
と を吹き込むと、
を吹き込むと、 の沈殿が得られる。・・・(1)
の沈殿が得られる。・・・(1)
 を加熱分解すると、目的物である固体の
を加熱分解すると、目的物である固体の と、気体の
と、気体の 、液体の
、液体の になる。・・・(2)
になる。・・・(2)
- 「アンモニア・ソーダ法」のすぐれた点は、
 と
と の再利用がうまくなされていることにある。
の再利用がうまくなされていることにある。
- まず、
 の再利用について見る。
の再利用について見る。
(1)の工程で、副産物として、 が出る。この物質は、「弱塩基」である
が出る。この物質は、「弱塩基」である と、「強酸」である
と、「強酸」である の「塩」と見ることができるから、固体である
の「塩」と見ることができるから、固体である に「強塩基」の液体を作用させると、「弱塩基」である
に「強塩基」の液体を作用させると、「弱塩基」である を気体として取り出すことができるはずである。
を気体として取り出すことができるはずである。
比較的安価に得られる「強塩基」として が選ばれた。
が選ばれた。
- 石灰岩の主成分は
 であるが、これを強熱して分解すると、「酸性酸化物」である気体の
であるが、これを強熱して分解すると、「酸性酸化物」である気体の と、「塩基性酸化物」である固体の
と、「塩基性酸化物」である固体の になる。・・・(3)
になる。・・・(3)
- 一般に
 の酸化物は「塩基性酸化物」であるが、このうち、水に溶解するのは、
の酸化物は「塩基性酸化物」であるが、このうち、水に溶解するのは、 と
と の酸化物のみである。これらは水に溶解すると、完全に電離し、強塩基性を示す。
の酸化物のみである。これらは水に溶解すると、完全に電離し、強塩基性を示す。 は、
は、 の酸化物であるから、水に溶けて強塩基性を示す
の酸化物であるから、水に溶けて強塩基性を示す となる。・・・(4)
となる。・・・(4)
- こうして、
 に
に を加えて
を加えて を得ることができた。・・・(5)
を得ることができた。・・・(5)
- 石灰岩の主成分は
- 次に
 は、(1)および(3)の反応で生じるものを再利用することができる。
は、(1)および(3)の反応で生じるものを再利用することができる。
- それぞれを化学反応式で表すと、
NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl ・・・(1)
2NaHCO3 → Na2CO3 + CO2 + H2O ・・・(2)
CaCO3 → CO2 + CaO ・・・(3)
CaO + H2O → Ca(OH)2 ・・・(4)
2NH4Cl + Ca(OH)2 → 2NH3 + 2H2O + CaCl2 ・・・(5)
2×(1)+(2)+(3)+(4)+(5)から、
2NaCl+CaCO3→Na2CO3+CaCl2
となるから、もし、再利用が完全に行われたら、 と
と は、一切補充することなく、
は、一切補充することなく、 2モルと、
2モルと、 1モルから、目的物
1モルから、目的物 1モルを得ることができることがわかる。
1モルを得ることができることがわかる。
(1) 炭酸ナトリウム, (2) 二酸化ケイ素, (3) 食塩, (4) アンモニア, (5) 二酸化炭素, (6) 炭酸水素ナトリウム, (7) 水, (8) 塩化アンモニウム, (9) 塩酸, (10) 水酸化カルシウム, (11) 炭酸カルシウム, (12) 酸化カルシウム, (13) 金属, (14) アルカリ金属, (15) アルカリ土類金属,
- 現代社会で、最も大量に用いられている金属は、鉄とアルミニウムであろう。鉄は「硬い」こと、アルミニウムは「
 」て加工しやすいこと、「イオン化傾向」がかなり大きいにもかかわらずいずれも安定な「酸化皮膜(
」て加工しやすいこと、「イオン化傾向」がかなり大きいにもかかわらずいずれも安定な「酸化皮膜( )」を形成するから、酸などに侵されにくいことが、何よりもその特徴である。
)」を形成するから、酸などに侵されにくいことが、何よりもその特徴である。
- 人類は歴史の中で、金属を「
 」の小さいものから順に利用してきた。金や銀など、「
」の小さいものから順に利用してきた。金や銀など、「 」の非常に小さな金属は、地中に単体のまま存在しているから、採掘してそのまま使うことができるのに対し、銅や鉄は、「
」の非常に小さな金属は、地中に単体のまま存在しているから、採掘してそのまま使うことができるのに対し、銅や鉄は、「 」として地中に存在するから、これらを利用するには、「
」として地中に存在するから、これらを利用するには、「 」の技術が必要だったからだ。
」の技術が必要だったからだ。
- 光合成を行う植物が大量の「
 」を大気に蓄積したからこそ、動物は海中から陸上に生活の場を移すことができたのだが、大気中の「
」を大気に蓄積したからこそ、動物は海中から陸上に生活の場を移すことができたのだが、大気中の「 」の存在によって、「
」の存在によって、「 」が大きい金属はすべて徹底的に酸化され、鉄もアルミニウムも地中にはすべて
」が大きい金属はすべて徹底的に酸化され、鉄もアルミニウムも地中にはすべて 価(赤鉄鉱Fe2O3、アルミナAl2O3)のイオンの形で存在している。
価(赤鉄鉱Fe2O3、アルミナAl2O3)のイオンの形で存在している。
- 「
 」が安定であることは、利用の面では利点となるが、鉱石を「
」が安定であることは、利用の面では利点となるが、鉱石を「 」して単体を得るには障害となった。
」して単体を得るには障害となった。
(1) 軽く, (2) 不動態, (3) イオン化傾向, (4) 酸化物, (5) 還元, (6) 酸素, (7) +3,
- 「高炉」では、コークス(石炭の乾留によって得られた個体の炭素)と二酸化炭素との反応で生じた
 を
を 剤として、鉄鉱石を
剤として、鉄鉱石を していく。
していく。
鉄鉱石の主成分は (Fe2O3)であるが、これが順次、四酸化三鉄(Fe3O4)、酸化鉄(II)、鉄の単体と
(Fe2O3)であるが、これが順次、四酸化三鉄(Fe3O4)、酸化鉄(II)、鉄の単体と されていく。
されていく。
このとき鉄の酸化数は、 → +2と+3の混合物 →
→ +2と+3の混合物 →  →
→  と変化している。「高炉」で出来上がった鉄の単体を
と変化している。「高炉」で出来上がった鉄の単体を と呼ぶ。
と呼ぶ。
- 「高炉」で得られた
 は、不純物として
は、不純物として を多く含んでいるため、もろい。「転炉」では、
を多く含んでいるため、もろい。「転炉」では、 を高温で融解し、
を高温で融解し、 を吹き込むことで、不純物の
を吹き込むことで、不純物の を
を して取り除く。こうして得られた純度の高い、強度の高い鉄を
して取り除く。こうして得られた純度の高い、強度の高い鉄を と呼ぶ。
と呼ぶ。
(1) 一酸化炭素, (2) 還元, (3) 酸化鉄(III), (4) +3, (5) +2, (6) 0, (7) 銑鉄, (8) 炭素, (9) 酸素, (10) 酸化, (11) 鋼,
- 「イオン化傾向」が
 より大きい金属の単体は、水溶液の電気分解によって析出して取り出すことは、決してできない。
より大きい金属の単体は、水溶液の電気分解によって析出して取り出すことは、決してできない。
水溶液中には、水分子または水素イオンが必ず存在するから、 では、これらが優先的に電子を受け取り、
では、これらが優先的に電子を受け取り、 されて気体の
されて気体の が発生してしまうからである。
が発生してしまうからである。
- そこで、これらの金属については、そのイオンを含む塩を高温で融解し、水を一滴も加えないで電気分解を行って析出させる。この方法を「
 」と呼び、例えば食塩の「
」と呼び、例えば食塩の「 」によって
」によって の単体を得ている。
の単体を得ている。
- アルミニウムは、地殻の元素の組成では、
 、
、 についで3番目に多量に含まれているがが、「イオン化傾向」が高いため、すべて酸化され
についで3番目に多量に含まれているがが、「イオン化傾向」が高いため、すべて酸化され 価のイオンとして存在している。アルミニウムの鉱石は「
価のイオンとして存在している。アルミニウムの鉱石は「 」と呼ばれ、主成分は
」と呼ばれ、主成分は (アルミナ、Al2O3)である。
(アルミナ、Al2O3)である。
- アルミニウムの単体は、「イオン化傾向」が非常に高いにもかかわらず、濃硝酸などの強力な
 剤にも溶けない。これは
剤にも溶けない。これは の皮膜(不動態)が非常に強力であることを意味している。
の皮膜(不動態)が非常に強力であることを意味している。
 の融点はきわめて高く、これが「
の融点はきわめて高く、これが「 」では難点になった。20世紀のはじめに、「
」では難点になった。20世紀のはじめに、「 」と呼ばれるアルミニウム化合物を混合することで劇的に融点を下げる方法が発見され、初めて実用化されるようになった。
」と呼ばれるアルミニウム化合物を混合することで劇的に融点を下げる方法が発見され、初めて実用化されるようになった。
- しかし、「
 」では大量の電力を消費するので、アルミニウム生産のコストは大きい。アルミ製品のリサイクルがうまく機能しているのはこのためである。
」では大量の電力を消費するので、アルミニウム生産のコストは大きい。アルミ製品のリサイクルがうまく機能しているのはこのためである。
- 「
 」の電極には
」の電極には が用いられる。
が用いられる。
 では、1molの酸化アルミニウム(Al2O3)が
では、1molの酸化アルミニウム(Al2O3)が molの電子を受け取って、
molの電子を受け取って、 molのアルミニウムの単体に変化する。
molのアルミニウムの単体に変化する。
 では、炭素が不完全燃焼して、
では、炭素が不完全燃焼して、 の気体が発生する。
の気体が発生する。
[問] 27gのアルミニウムを得るためには、1[A]の電流を何分間流す必要があるか?
ファラデー定数は96500[C/mol]、Al=27とする。
(1) 水素, (2) 陰極, (3) 還元, (4) 融解塩電解, (5) ナトリウム, (6) 酸素, (7) ケイ素, (8) +3, (9) ボーキサイト, (10) 酸化アルミニウム, (11) 酸化, (12) 氷晶石, (13) 炭素, (14) 陰極, (15) 6, (16) 2, (17) 陽極, (18) 一酸化炭素,
- エタノールの酸化(実験室的製法)
- 「第1級アルコール」を酸化すると、
 を経て
を経て になる。この第2段階の酸化は、きわめて速やかに行われるため、
になる。この第2段階の酸化は、きわめて速やかに行われるため、 には「
には「 性」があると言われる。
性」があると言われる。
- エタノールに、ニクロム酸カリウムなどの強力な
 剤を加えると、
剤を加えると、 を経て直ちに
を経て直ちに まで、
まで、 されてしまう。
されてしまう。
そこで、エタノールと の沸点の違いに着目して、発生した
の沸点の違いに着目して、発生した をいったん気体にした上、冷却して液体で取り出す方法が考案された。
をいったん気体にした上、冷却して液体で取り出す方法が考案された。
エタノールは極性の大きな をもっているため、その沸点(約80°C)は、
をもっているため、その沸点(約80°C)は、 の沸点(約20°C)よりもかなり高い。
の沸点(約20°C)よりもかなり高い。
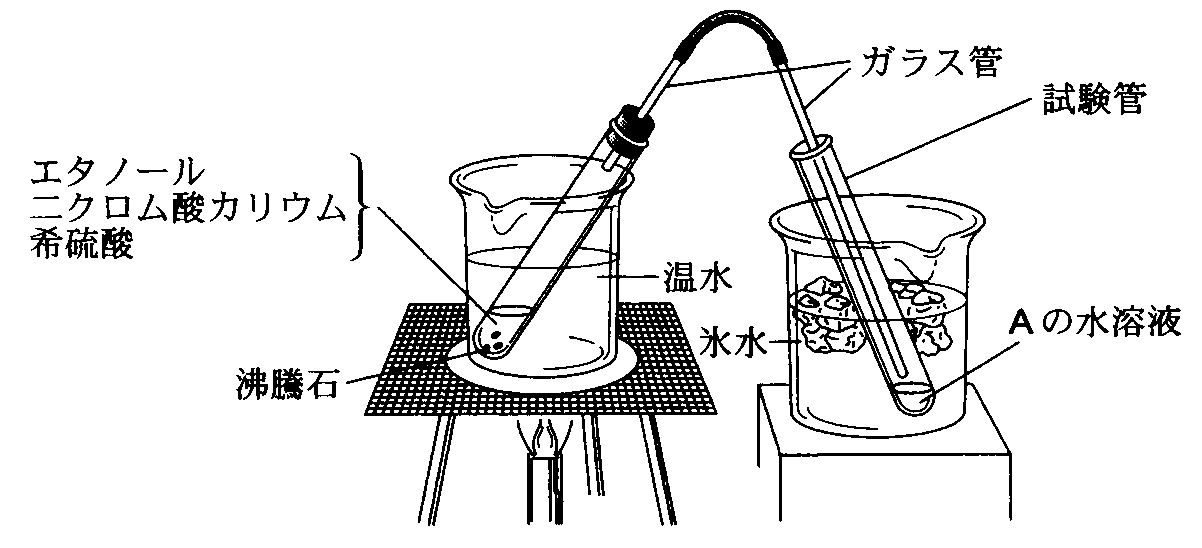
- 「第1級アルコール」を酸化すると、
- アセチレンの水付加(かつての工業的製法)
 に
に を付加すると、ビニルアルコールという不安定な化合物を経て
を付加すると、ビニルアルコールという不安定な化合物を経て が生じる。
が生じる。
- 工業的製法として長らく用いられてきたが、触媒に
 を用いることから甚大な環境被害をもたらしたため、現在は用いられていない。
を用いることから甚大な環境被害をもたらしたため、現在は用いられていない。
 の酸化(現在の工業的製法)
の酸化(現在の工業的製法)
(1) アルデヒド, (2) カルボン酸, (3) 還元, (4) 酸化, (5) アセトアルデヒド, (6) 酢酸, (7) ヒドロキシル基, (8) アセチレン, (9) 水, (10) 水銀, (11) エチレン,
- ベンゼンスルホン酸のアルカリ融解
 に濃硫酸を加えて加熱すると、濃硫酸の
に濃硫酸を加えて加熱すると、濃硫酸の 作用により、
作用により、 が得られる。この反応を
が得られる。この反応を と呼ぶ。
と呼ぶ。
 に固体の
に固体の を混ぜて加熱すると、
を混ぜて加熱すると、 が得られる。この過程を「
が得られる。この過程を「 」と呼んでいる。
」と呼んでいる。
 は、
は、 の塩だから、
の塩だから、 よりも
よりも い酸、例えば二酸化炭素や塩酸を作用させると、最も
い酸、例えば二酸化炭素や塩酸を作用させると、最も い酸である
い酸である が得られる。
が得られる。
- クロロベンゼンに水酸化ナトリウム水溶液を作用させる
 の二重結合はとても安定なので、紫外線などの高エネルギーを加えない限り
の二重結合はとても安定なので、紫外線などの高エネルギーを加えない限り 反応は起こさず、
反応は起こさず、 反応を行う。
反応を行う。
 に塩素を作用させるときも、紫外線を照射すると
に塩素を作用させるときも、紫外線を照射すると 反応を行って、
反応を行って、 を生じるが、通常は
を生じるが、通常は 反応によって
反応によって を生じる。
を生じる。
 に鉄を触媒として塩素を作用させると、
に鉄を触媒として塩素を作用させると、 反応により
反応により を生じる。
を生じる。
 に、高温高圧化で
に、高温高圧化で 水溶液を作用させると、
水溶液を作用させると、 が得られる。
が得られる。
 は、
は、 の塩だから、
の塩だから、 よりも
よりも い酸、例えば二酸化炭素や塩酸を作用させると、最も
い酸、例えば二酸化炭素や塩酸を作用させると、最も い酸である
い酸である が得られる。
が得られる。
- クメン法(工業的製法)
 に
に を
を させると、
させると、 ができる。
ができる。
- これを
 した後、分解すると、
した後、分解すると、 とともに
とともに が得られる。
が得られる。
(1) ベンゼン, (2) 脱水, (3) ベンゼンスルホン酸, (4) スルホン化, (5) 水酸化ナトリウム, (6) ナトリウムフェノキシド, (7) アルカリ融解, (8) フェノール, (9) 強, (10) 弱, (11) 付加, (12) 置換, (13) ヘキサクロロシクロヘキサン, (14) クロロベンゼン, (15) プロペン(プロピレン), (16) クメン, (17) 酸化, (18) アセトン,
- ベンゼン環の側鎖のメチル基を酸化すると、最終的にはカルボキシル基まで酸化される。
- このことから、
 を酸化すると安息香酸、
を酸化すると安息香酸、 を酸化するとフタル酸、
を酸化するとフタル酸、 を酸化するとテレフタル酸が得られることがわかる。
を酸化するとテレフタル酸が得られることがわかる。
- フタル酸では、2個のカルボキシル基が接近しているため、容易に分子内脱水して
 を生じるが、テレフタル酸では、2個のカルボキシル基が離れているため、このような反応は起こらない。
を生じるが、テレフタル酸では、2個のカルボキシル基が離れているため、このような反応は起こらない。
- テレフタル酸と、2価アルコールである
 との、「
との、「 」によって得られた高分子化合物は
」によって得られた高分子化合物は として知られている。この化合物は分子内に多数の「
として知られている。この化合物は分子内に多数の「 結合」をもつため、「
結合」をもつため、「 系合成繊維」と呼ばれる。
系合成繊維」と呼ばれる。
(1) トルエン, (2) o-キシレン, (3) p-キシレン, (4) 無水フタル酸, (5) エチレングリコール, (6) 縮重合(縮合重合), (7) PET(ポリエチレンテレフタレート), (8) エステル, (9) ポリエステル,
- サリチル酸は、ベンゼン環の
 の位置に、フェノール性
の位置に、フェノール性 と、
と、 をもった化合物である。
をもった化合物である。
 は、最も弱い酸である
は、最も弱い酸である の塩であるから、これに二酸化炭素を加えると、
の塩であるから、これに二酸化炭素を加えると、 が発生する。
が発生する。
ところが、 に、高温・高圧下で二酸化炭素を作用させると、次のようなサリチル酸のナトリウム塩が生じる。
に、高温・高圧下で二酸化炭素を作用させると、次のようなサリチル酸のナトリウム塩が生じる。
フェノール、二酸化炭素、カルボン酸の順に酸は強くなるから、二酸化炭素の存在下では、フェノール性 は電離できず、
は電離できず、 は電離できるからである。
は電離できるからである。
- この塩に、カルボン酸よりも強い酸、例えば、希
 などを作用させると、
などを作用させると、 は電離できず水に不溶性となるから、遊離させて取り出すことができる。
は電離できず水に不溶性となるから、遊離させて取り出すことができる。
 は、フェノール性
は、フェノール性 と
と の両方を持っているので、2種類のエステル化が可能である。
の両方を持っているので、2種類のエステル化が可能である。
 とメタノールのエステル化によって、
とメタノールのエステル化によって、 が得られる。これは、筋肉痛などに対する外用薬として利用されている。
が得られる。これは、筋肉痛などに対する外用薬として利用されている。
 と無水酢酸のエステル化によって、
と無水酢酸のエステル化によって、 が得られる。これは、副作用の少ない鎮痛剤として広く用いられている。
が得られる。これは、副作用の少ない鎮痛剤として広く用いられている。
(1) オルト, (2) ヒドロキシル基, (3) カルボキシル基, (4) ナトリウムフェノキシド, (5) フェノール, (6) 塩酸, (7) サリチル酸, (8) サリチル酸メチル, (9) アセチルサリチル酸,
 に濃硫酸と
に濃硫酸と を加えて加熱すると、濃硫酸の
を加えて加熱すると、濃硫酸の により、
により、 と
と から
から して、
して、 が得られる。この反応を
が得られる。この反応を と呼ぶ。
と呼ぶ。
 に塩酸とスズを加えると、
に塩酸とスズを加えると、 が生じる。ここで、スズは
が生じる。ここで、スズは 剤として作用している。
剤として作用している。
 は弱塩基であるアニリンの塩であるから、ここに強塩基として
は弱塩基であるアニリンの塩であるから、ここに強塩基として などを加えると、アニリンが遊離する。
などを加えると、アニリンが遊離する。
- アニリンに
 を作用させると、
を作用させると、 が得られる。この物質の-NH-CO-の構造は、「
が得られる。この物質の-NH-CO-の構造は、「 結合」と呼ばれ、生体内のタンパク質にも見られる。
結合」と呼ばれ、生体内のタンパク質にも見られる。
 に
に と塩酸を加えて
と塩酸を加えて すると、
すると、 が生じる。この反応を
が生じる。この反応を と呼ぶ。
と呼ぶ。
 は、きわめて熱に弱い物質であるから、加熱すると容易に分解して、
は、きわめて熱に弱い物質であるから、加熱すると容易に分解して、 、
、 、塩酸を生じる。
、塩酸を生じる。
 に
に を作用させると、
を作用させると、 という反応により、
という反応により、 の一種であるp-ヒドロキシアゾベンゼンが得られる。
の一種であるp-ヒドロキシアゾベンゼンが得られる。
(1) ベンゼン, (2) 濃硝酸, (3) 脱水, (4) ニトロベンゼン, (5) ニトロ化, (6) アニリン塩酸塩, (7) 還元, (8) 水酸化ナトリウム, (9) 無水酢酸, (10) アセトアニリド, (11) アミド, (12) 亜硝酸ナトリウム, (13) 冷却, (14) 塩化ベンゼンジアゾニウム, (15) ジアゾ化, (16) フェノール, (17) 窒素, (18) ナトリウムフェノキシド, (19) アゾカップリング, (20) アゾ染料,
- 多数の有機化合物が結合してできた分子量の大きな物質を高分子化合物といい、合成繊維や合成樹脂として広く用いられている。
高分子化合物の成り立ちには、大きく分けて2つの結合の仕方が用いられている。- 隣接する二重結合が切れて、長くつながってできたものを、「
 系高分子化合物」と呼ぶ。
系高分子化合物」と呼ぶ。
- 「エステル結合」、「アミド結合」のように、隣接する2つの分子の持つ基から、水などの単純な化合物が脱落して結合をつくるものを、「
 系高分子化合物」と呼ぶ。
系高分子化合物」と呼ぶ。
- 隣接する二重結合が切れて、長くつながってできたものを、「
- 「
 」によるものとしては、エチレンが
」によるものとしては、エチレンが してできた
してできた 、塩化ビニルが
、塩化ビニルが してできた
してできた 、スチレンが
、スチレンが してできた
してできた (発泡スチロール)などがある。
(発泡スチロール)などがある。
- 「
 」によるものには、エステル結合による「ポリエステル系」、アミド結合による「ポリアミド系」などがある。
」によるものには、エステル結合による「ポリエステル系」、アミド結合による「ポリアミド系」などがある。
- 芳香族2価カルボン酸である
 と、2価アルコールである
と、2価アルコールである のエステル化によって、
のエステル化によって、 (PET)がつくられている。
(PET)がつくられている。
- 2価カルボン酸である
 と、2価アミン(ジアミン)の一種である
と、2価アミン(ジアミン)の一種である から脱水し、多数のアミド結合によってつながった合成繊維が「
から脱水し、多数のアミド結合によってつながった合成繊維が「 」である。構成単位がいずれも6個の炭素でできていることからこの名前がある。
」である。構成単位がいずれも6個の炭素でできていることからこの名前がある。
- 芳香族2価カルボン酸である
(1) 付加重合, (2) 縮重合(縮合重合), (3) ポリエチレン, (4) ポリ塩化ビニル, (5) ポリスチレン, (6) テレフタル酸, (7) エチレングリコール, (8) ポリエチレンテレフタレート, (9) アジピン酸, (10) ヘキサメチレンジアミン, (11) 6-6ナイロン,
- 溶媒に対する溶解度の違いを利用して物質を取り出す方法を
 と呼ぶ。
と呼ぶ。
- 水はO-Hの構造を持っているため、非常に極性の大きな溶媒であるが、酸素の両端に炭素が結合した「エーテル結合」は、ほとんど極性を持たないので、エーテルはまったく水に溶けない。
- ジエチルエーテルは水よりもはるかに分子量が大きいが、水分子のように極性による大きな分子間力を持たないので、密度は小さく、分液ロートにジエチルエーテルと水を得れると、2層に分かれ、
 が上層、
が上層、 が下層になる。
が下層になる。
- 芳香族化合物は、無極性のベンゼン環を持つから、水には溶けず、同じく無極性のエーテルにはよく溶ける。
- 酸性の基であるフェノール性
 や、
や、 をもつもの、塩基性である
をもつもの、塩基性である をもつものは、電離している状態であれば、電荷の偏りがあるので、極性の強い水にも溶けることができる。
をもつものは、電離している状態であれば、電荷の偏りがあるので、極性の強い水にも溶けることができる。
- フェノール、安息香酸、アニリン、トルエンを含むジエチルエーテル溶液があったとする。
- 塩酸を加えてよく振り混ぜたのち静置すると、エーテル層と塩酸を含んだ水層の二層に分離するが、水層には電離した
 のイオンが含まれている。
のイオンが含まれている。
コックを開けて下層の水層を抜き取り、強塩基を加えると、 が遊離してくる。
が遊離してくる。
- 水酸化ナトリウム水溶液を加えてよく振り混ぜたのち静置すると、エーテル層と水酸化ナトリウムを含んだ水層に分離するが、水層には電離した
 のイオンと、
のイオンと、 のイオンが含まれていることになる。
のイオンが含まれていることになる。
これでは、 と
と を分離することができない。
を分離することができない。
- そこで、2つの酸性の基の電離度の違いに着目して、二酸化炭素の塩である
 の水溶液を加えると、
の水溶液を加えると、 は電離してイオンとなり水層に移るが、
は電離してイオンとなり水層に移るが、 は電離できずにエーテル層に残ることになる
は電離できずにエーテル層に残ることになる
水層を抜き取り、塩酸など、カルボン酸より強い酸を加えると、 を遊離させることができる。
を遊離させることができる。
- 残ったエーテル層に改めて水酸化ナトリウムを加えると、
 が電離してイオンとなって水層に移る。
が電離してイオンとなって水層に移る。
水層を抜き取って、 より強い酸である二酸化炭素、塩酸などを加えると、
より強い酸である二酸化炭素、塩酸などを加えると、 を遊離させることができる。
から、これらを分離して取り出すことができる。
を遊離させることができる。
から、これらを分離して取り出すことができる。
 は酸を加えても塩基を加えても電離できないから最後までエーテル層に残る。エーテルを揮発させることによって、これを取り出す。
は酸を加えても塩基を加えても電離できないから最後までエーテル層に残る。エーテルを揮発させることによって、これを取り出す。
- 塩酸を加えてよく振り混ぜたのち静置すると、エーテル層と塩酸を含んだ水層の二層に分離するが、水層には電離した
(1) 抽出, (2) ジエチルエーテル, (3) 水, (4) ヒドロキシル基, (5) カルボキシル基, (6) アミノ基, (7) アニリン, (8) フェノール, (9) 安息香酸, (10) 炭酸水素ナトリウム, (11) トルエン,
- アルデヒドの検出
 や
や には「還元性」があるので、金属陽イオンを還元させることによって検出する。
には「還元性」があるので、金属陽イオンを還元させることによって検出する。
- 銀鏡反応
アンモニア性硝酸銀を加えると、試験管の壁面に銀が し「鏡」のようになる。Ag+が還元されて銀の単体が生じたことによる。
し「鏡」のようになる。Ag+が還元されて銀の単体が生じたことによる。
「アンモニア性硝酸銀」というのは、銀イオンを沈殿させないための工夫である。硝酸イオンはどんな金属イオンとも沈殿を作らない。銀イオンは塩基性水溶液で沈殿するが、過剰のアンモニアに対しては錯イオンを作って溶ける。 - フェーリング反応
フェーリング液を加えると、銅(II)イオンが還元され酸化銅(I)の 沈殿が生じる。
沈殿が生じる。
フェーリング液とは、硫酸銅(II)水溶液、酒石酸ナトリウムカリウムと水酸化ナトリウムの混合溶液
- 銀鏡反応
- ヨードホルム反応
- アルデヒド基の一方がメチル基であるもの(アセトアルデヒド)、ケトン基の一方がメチル基であるもの、
つまり CH3-CO-R (Rは水素または炭素)の構造を持つものは、ヨウ素と水酸化ナトリウムを加えると、ヨードホルムの 結晶を生じる。
結晶を生じる。
- ところが、ハロゲンであるヨウ素には
 力があるので、酸化されて上のような構造を持つことになる、第1級アルコールや第2級アルコールも、ヨードホルム反応を示すことになる。
力があるので、酸化されて上のような構造を持つことになる、第1級アルコールや第2級アルコールも、ヨードホルム反応を示すことになる。
- 結局、ヨードホルム反応を示す化合物は、
- 端から2番目の炭素原子にヒドロキシル基が付いた、第1級または第2級アルコール、
- および、それらを酸化して得られるアルデヒドまたはケトン
 、
、 、
、 、
、 などがある。
などがある。
- アルデヒド基の一方がメチル基であるもの(アセトアルデヒド)、ケトン基の一方がメチル基であるもの、
- フェノール類の検出:塩化鉄(III)による呈色
- フェノール性
 (ベンゼン環に直結した
(ベンゼン環に直結した )を持つものはすべて、塩化鉄(III)によって呈色する。
)を持つものはすべて、塩化鉄(III)によって呈色する。
- フェノール、クレゾール、サリチル酸、サリチル酸メチル、アセチルサリチル酸のうちで、塩化鉄(III)で呈色しないものは、
 だけである。
だけである。
- フェノール性
- フェノールの検出
臭素水を加えると、 の白色沈殿を生じる。
の白色沈殿を生じる。
- アニリンの検出
アニリンは、 をスズによって
をスズによって してつくる。このことからも、アニリンの窒素の酸化数が低い状態にあることがわかる。したがって、アニリンの検出には、いずれも強力な
してつくる。このことからも、アニリンの窒素の酸化数が低い状態にあることがわかる。したがって、アニリンの検出には、いずれも強力な 剤が用いられる。
剤が用いられる。
- さらし粉反応(赤紫色)
さらし粉には が含まれ、消毒、殺菌作用がある。これは
が含まれ、消毒、殺菌作用がある。これは の酸化力による。
の酸化力による。
- アニリンブラック
代表的な酸化剤である によって酸化され、黒色を呈する。
によって酸化され、黒色を呈する。
- さらし粉反応(赤紫色)
(1) アルデヒド, (2) ギ酸, (3) 析出, (4) 赤色, (5) 黄色, (6) 酸化, (7) エタノール, (8) 2-プロパノール, (9) アセトアルデヒド, (10) アセトン, (11) ヒドロキシル基, (12) アセチルサリチル酸, (13) 2,4,6-トリブロモフェノール, (14) ニトロベンゼン, (15) 還元, (16) 酸化, (17) 次亜塩素酸イオン, (18) ニクロム酸カリウム,