2012年「センターテスト」、ご質問が多かった、いくつかの問題について。
- 数学IIB第1問[2]

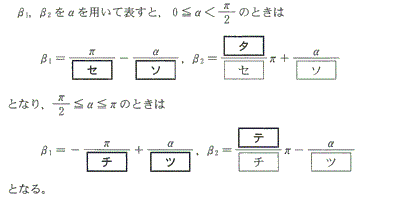
[2012本1_2]
- 化学第3問問2

(5)[2012本3_2]
- 非金属の酸化物は、「酸性酸化物」である。
- 「酸」は、狭い意味では、「水に溶けて、水素イオン(オキソニウムイオン)を生ずるもの」、
少し広い意味では、「水に溶けなくても、塩基と反応(中和)するもの」、と定義される。
- 非金属酸化物は、分子性物質であるから、それが水に溶けるか否か?は、分子の立体構造による。
(酸素は、フッ素に次いできわめて陰性の強い元素であるから、他の元素との共有結合においては、かならず強い極性を生み出す。
だから同じ極性溶媒である水にとける場合が多い。溶けないのは、NO、CO、ぐらいだ。)
- 金属の酸化物は、「塩基性酸化物」である。
- 「塩基」は、狭い意味では、「水に溶けて、水酸化物イオンを生ずるもの」、
少し広い意味では、「水に溶けなくても、酸と反応(中和)するもの」、と定義される。
- 金属酸化物は、イオン結合性物質。(それが水にとけるか否か?は、イオン間のクーロン力と、陽イオンのまわりに取り付いた水分子との間の水和結合のクーロン力との大小で決まるだろう。
一般に、陽性が強い金属のイオンほど、水に溶けやすく、沈殿も作りにくい、と、大雑把には言える。)
金属酸化物のうち、水に溶けるのは、アルカリ金属およびアルカリ土類金属の酸化物のみである。
- 両性元素の酸化物は、「両性酸化物」である。
- 「両性」とは、「酸」と「塩基」両方の性質を兼ね備えている、ということである。
- 両性元素も、金属であって、かつ、アルカリ金属、アルカリ土類金属ではないから、その酸化物は、一切水に溶けない。
だから、
- 両性酸化物が、「酸」である、というのは、水に溶けて水素イオンを生ずることはないが、「塩基」と中和反応を行う、という意味であり、
- 両性酸化物が、「塩基」である、というのは、水に溶けて水酸化物イオンを生ずることはないが、「酸」と中和反応を行う、という意味である。
- ところで、以上の議論は、すべて、「酸・塩基反応」、すなわち「酸化還元反応」ではない反応、にかかわるものである。
選択肢のうち、ただ一つだけ、この論点が、混同されているものがある!!
(5)の反応が、もし起こるとしたら、Pbの酸化数は、(+4)から、(+2)に変わっている。つまり「酸化還元反応」になっている!
- だから、この反応が起こるためには、どこかに、「還元剤」が必要なのだ。
鉛蓄電池の正極では、たしかにこの反応が、起こっている、が、それは、負極の鉛単体(Pb)と銅線で接続され、そこから電子の供給を受ける、つまり、「還元剤」Pbが存在している、という条件の下だからであって、・・・
正極・負極間を抵抗で接続しない状態でも、つまり、自動車のバッテリーが、販売店の店頭に並べてある間も(!)、正極がじわじわ溶け出している(!)、というのは困るだろ?




