A phenomenon very much akin to Brownian movement is that of diffusion; Imagine a vessel filled with a fluid, say water, with a small amount of some colored substance dissolved in it, say potassium permanganate, not in uniform concentration, but rather as in Fig. 4, where the dots indicate the molecules of the dissolved substance (permanganate) and the concentration dimisishes from left to right. If you leave this system alone a very slow process of 'diffusion' sets in, the permanganate spreading in the direction from left to right, that is from the places of higher concentration towards the places of lower concentration, until it is equally distributed through the water.

ブラウン運動と極めてよく似た現象に「拡散」がある。液体、例えば水、をみたした容器を想像しよう。そこには、少量の色のついた物質、例えば過マンガン酸カリウムが溶けている。ただその溶け方は、決して一様な濃度ではなく、図4に示すように、濃度は左から右に向かって次第に小さくなっていく。図中の一つ一つの点は、溶質(ここでは過マンガン酸イオン)の分子を表している。この系を放置しておくと、極めてゆっくりとした「拡散」の過程が始まる。過マンガン酸イオンは左から右、つまり濃度の高い場所から、濃度の低い場所に向かって、液体中に均等に分散されるようになるまで、広がっていくのである。
The remarkable thing about this rather simple and apparently not particularly interesting process is that it is in no way due, as one might think, to any tendency or force driving the permanganate molecules away from the crowded region to the less crowded one, like the population of a country spreading to those parts where there is more elbow-room. Nothing of the sort happens with our permanganate molecules. Every one of them behaves quite independently of all the others, whichi it very seldom meets. Every one of them, whether in a crowded region or in an empty one, suffers the same fate of being continually knocked about by the impacts of the water molecules and thereby gradually moveing on in an unpredictable direction - sometimes towards the higher, sometimes towards the lower, concentrations, sometimes obliquely. The kind of motion it performs has often been compared with that of a blindfolded person on a large surface imbued with a certain desire of 'walking', but without any preference for any particular direction, and so changing his line continuously.
この、かなり単純で、しかも一見したところ大して面白くもなさそうな過程にはしかし極めて特筆すべき重要な事柄が関連していて、それというのは、我々が思わず思い込んでしまいそうな風に、過マンガン酸イオンの分子が、何らかの傾向、もしくは、推進力によって、混みあった地帯から、より混み合っていない地帯に向かって、そう、まるである国の人口がより場所的な余裕のある地方へと広がっていくように、引き寄せられている、というようなことでは、全然、ない、ということなのだ。私たちがいま観察している過マンガン酸イオンの分子にはそのような事柄は、一切、生じていない。それら分子の一つ一つは、他の分子と、全く独立に、振舞っている。そもそも、それらの分子同士が出会うことさえ、ほとんどない。一つ一つの分子は、それが混みあった地帯にいようが、スカスカの場所にいようが、まったく同じ運命、常に衝突してくる水分子の衝撃を受け、従って常に予測不可能な方向へ、ときには濃度の濃い方へ、ときには濃度の薄い方へ、またときには、どっちだかはっきりしない方向へ、移動し続けることになるのだ。例えて言うならば、目隠しをされた人が、広い場所に連れ出され、ただ「歩きたい」という欲望だけは刷り込まれているのだが、特にどちらへ向かってという志向はもっていない、といった場合に似ている。従ってその人は、常時歩く方向を変えざるを得ないのだ。
That this random walk of the permanganate molecules, the same for all of them, should yet produce a regular flow towards the smaller concentration and ultimately make for uniformity of distribution, is at first sight perplexing - but only at first sight. If you contemplate in Fig.4 thin slices of approximately constant concentration, the permanganate molecules which in a given moment are contained in a particular slice will, by their random walk, it is true, be carried with equal probability to the right or to the left. But precisely in cosequence of this, a plane separating two neighbouring slices will be crossed by more molecules coming from the left than in the opposite direction, simply because to the left there are more molecules engaged in random walk than there are to the right. And as long as that is so the balance will show up as a regular flow from left to right, until a uniform distribution is reached.
Erwin Schrodinger/What is Life?
このすべての過マンガン酸イオンに共通の、出鱈目な歩みこそが、より濃度の低い方への定常的な流れを作り出し、究極的には、一様な分布を作り出す、という考えは、一見したところでは、人々を困惑させるかも知れない。ただ、それは、一見したところ、だけに過ぎない。図4の溶液を、ほぼ等しい濃度と見なしうるような薄い層に分割してみたところを想像してみられたい。ある瞬間、ある特定の薄層に存在する個々の過マンガン酸イオン分子は、まさにこの出鱈目な歩みによって、右または左に等しい確率で運ばれる。しかし、まさにその結果として、二つの隣接する薄層を隔てている境界面を、左から通過する分子の方が、反対方向に通過する分子よりも、多くなるのである。左側には、この出鱈目な歩みを行っている分子が、右に比べてたくさん存在している、という単純な理由によって。このような状態が続く限り、左から右へと向かう定常的な流れが生じ、最終的には、均一な分布に到達するのである。
アーウィン・シュレディンガー「生命とは何か」
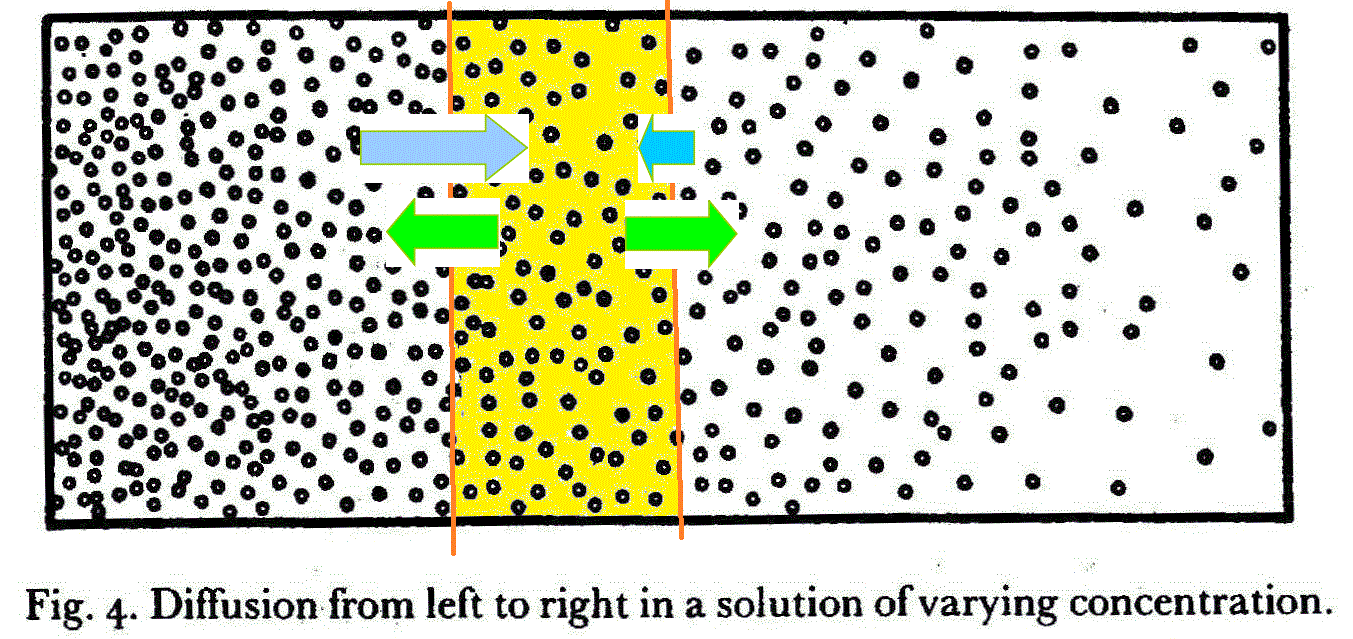
図4、左から右に向かって濃度勾配をもった溶液中の拡散現象
シュレディンガーに言われた通り(笑)、図4の溶液を、薄層に区切ってみた。その一つが黄色で表されている。微分積分学の教えるところ、十分短い曲線は、直線、なのである。同様に、濃度勾配のある容器中でも、十分薄い層では、濃度一定とみなしてよい。黄色の薄層中に存在する過マンガン酸イオン分子は、出鱈目歩き(random_walk)、まさに「ランダム」だからこそ、区別する「理由」がない、からこそ、右側の境界面と左側の境界面に、等しい確率てぶち当たる。「壁」があるとすればの話だが、・・・、「壁」はないのだから、境界面を通過して隣接する薄層に移る確率、と言ってよい。それが緑の矢印で表示されている。
この薄層に直近左側の層でも、同様なことが生じているはずだが、まさに、現段階で左側の方が濃度が高い、たくさんの過マンガン酸分子が存在する、というそ・れ・だ・け・の・理・由・で・、左側の境界面から、この薄層に移動してくる分子数は、同じ境界面を反対に、左隣の薄層に出ていく分子数より、多くなることが予想される。右向きの青色の矢印が、左向きの緑の矢印より長く描かれているのは、そういう意味だ。
右側の境界面について考えれば、これまた、直近右側の層には、より少ない数の過マンガン酸イオンしか存在していない、というた・だ・そ・れ・だ・け・の・理・由・で・、右側からこちらに移動してくる分子数は、右側へ出て行く分子数より、少なくなることが予想されるのである。左向きの青い矢印は、だから緑の右向きの矢印より短くしてある。
このようにして、左から右への「流れ」が生じる。「流れ」が生じたのは、濃度の「差」があったからである。「差」が存在しているからこそ、「差」を減殺する方向へ、「流れ」が生じるのである。「流れ」によって「差」は次々に小さくなるから、やがていつかは、もはや「流れ」を作り出す「差」がなくなってしまう時が来る。
それがエントロピーの極大値であり、そこからは、もはや何事も起こらない、「世界の終わり」、である。過マンガン酸カリウム水溶液の入った容器、というこの「世界」では、濃度がいたるところ均等になってしまった状態の謂である。
熱力学第二法則、エントロピー増大則、とは、どうやら、「確率の小さい、あまり起こりそうにもない状態、から、確率の大きい、とても平凡な事態、へと物事は推移する」、と言っているらしい。もちろん私の貧しい理解力の限界内では、・・・、ということだが。貧しい知性がついていけるように、話をものすごく単純化する。この容器がたった3個の薄層で出来ていて、過マンガン酸イオン分子に当たるものが、たった6個しかなかった、としよう。「区別のつかない6個の赤玉」、などとは言わない。「私」は(笑)、ちゃんと区別ができるから、それを、a,b,c,d,e,fと、名付ける。一方薄層の方は、左から順にI,II,IIIとしよう。
これは、部屋I,II,IIIを、旅人a,b,c,d,e,fが「選ぶ」という例え話にできる。「自由意思」を有した各旅人は、独立に「意思決定」できるから、彼らそれぞれに与えられた選択肢は、I,II,IIIの3通り、「通謀」、「根回し」などの不正行為が行われない限り(笑)、36通りの場合が、全く均等に、ありうる。
- 初めに、過マンガン酸カリウムが一滴、容器の左端にて聞かされた状態は、6個の分子がことごとくIの部屋のみに存在している状態に例えられる。これを、「|」を部屋の「仕切り」の記号として、
|a,b,c,d,e,f|||
と、表記しよう。6人全員が、「私はIにする」と選んだ場合であるから、その場合の数は1、確率は1/36=1/729、である。

- 次第に拡散が生じ、ちょうど図4の如き状態になった瞬間、たった6個しか粒子がないので「濃度勾配」をつけるにはこれしか方法がないが、Iに3人、IIに2人、IIIに1人、がいる状態を考える。
|a,b,c|d,e|f|
|a,b,d|c,e|f|
・・・
等々の場合がありうるが、これらすべての場合の数は、
まず、Iに入る3人を決める、6C3、次に、IIに入る2人を残り3人から選ぶ、3C2、IIIに入る1人は自動的に決まる、1C1、よって、
6C3×3C2×1C1=20×3×1=60
その確率は、60/729=20/243、となる。

- そして、最後に、もはや、濃度差が失われてしまった状態、すべての部屋に2人ずつがいる。
|a,b|c,d|e,f|
|a,c|b,d|e,f|
・・・
同様に、
6C2×4C2×2C2=15×6×1=90

確率は、90/729=10/81、となる。
こうしてなるほど、「拡散」という現象は、極めて単純化して考えると、確かに、「確率の小さい状態、から、確率の大きい状態」への推移であることが理解される。ここでの「確率」ないしは「場合の数」に対応する何らかの数値を、「エントロピー」と呼ぶのならば、事態は、エントロピーが増大する方へと、推移する。
「長い目」(笑)で見るならば、「世界」は、間違いなくエントロピー極大に向かって、「終焉」に向かっているのである。ただし、上のシュレディンガーの文章にも、
If you leave this system alone「この系を放置しておくと」
と、あるように、「系の外部からのエネルギーの供給がない限り」という限定が付されることになる。どうやら「世界」は、「終焉」をひたすらやや遅延させるために、局所的にエントロピーを減少させる、という最終的には(笑)「虚しい」努力を懸命に続けている「システム」であるらしい。
「宇宙船地球号」にとって、「外部」のエネルギー源とは、原子核に閉じ込められた、途方もない大きさの、人間にはとても扱いきれない桁数の「プロメティウスの火」を除けば、・・・、「太陽」しかありえない。そして、その太陽光のエネルギーを、空しく失われていく「日差し」や「熱」ではなく、化学結合の中に「閉じ込めて」、後日、利用することができる能力を持っているのは、この世に、「緑色植物」しかなく、「私たち」、地上のすべての生き物は、「緑色植物」が閉じ込めたエネルギーをいわば「奪い取って」、今度は自らのタンパク質合成という、エントロビー減少過程を、「虚しく」しかし、懸命に繰り返しているわけなのである。
これは、C6H12O6、グルコースの分子模型である。箱の中に炭素原子6個、水素原子12個、酸素原子6個が入っていたとする。蓋をしてよく振り混ぜて(笑)、放置しておく。しばらくして蓋を開けてみたら、あら、こんな分子が出来ていた、などということは、ほぼ絶対にありえない、極端に確率の低い、極端な低エントロピー状態なのである。もっとも、私たちの常識からは、では、蓋を開けてみたら、水分子と二酸化炭素分子が、それぞれ6個ずつ出来ていた、というのも、同じくらいありえないことに思えるのだが、その「ありえなさ」には、まことに「雲泥の差」があるので、水分子6個、二酸化炭素分子6個、そんな比較的「単純な」、すなわち高エントロピーな分子から、グルコースなどという、途方もなく複雑な分子を組み立てるのは、「途方もない」エントロピー減少過程であって、そんな奇跡のようなことができるのは、ひとえに、「緑色植物」が「光合成」という仕組みを獲得し、「外部」、太陽光のエネルギーを取り込むことができたからなのである。
「生きる」というのはいわば、「遅延された」死なのであって、私たちが、緑色植物の作り出した栄養を取り込み、外気から取り入れた酸素によってそれを燃焼し、そのエネルギーを用いて、日々、時々刻々壊れつつある、タンパク質の構造を組み立てなおす。「死」が訪れた瞬間、急速に体温が失われ、腐敗、バクテリアによる分解、というエントロピー増大過程が、「始まる」かのように思えるが、いや、そうではない。常に進行している崩壊の過程と、それに抗して構造を組み立てなおすエントロピー減少過程が、奇跡的に「釣り合って」いたからこそ、まるで「定常的」に、存在しているかのように「見えた」のである。「死」とともに一方の過程が終了したから、他方の過程のみが「あらわに」なったのである。





