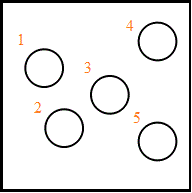
「ポジション」に区別がつく、というのだから、上の図のように、「玉」・気体分子の存在しうる場所、各層に5個づつに、「名前」が付けられる。
(左1,左2,左3,左4,左5,右1,右2,右3,右4,右5)、という風に。
ところが(笑)、「状態II」という言い方にはもともとそんな含意がなく、ただ、「赤玉」が、「左」の層に3個、「右」の層に1個、ある、ということしか言ってない。そうなってしまうと、この図、
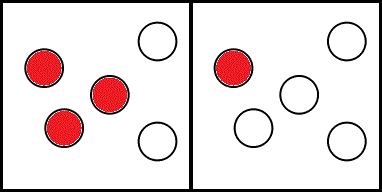 状態II
状態II
は、数ある「状態」の、一つの例示、ということになってしまう。
(左1,左2,左3,左4,左5,右1,右2,右3,右4,右5)、という風に表記できるだろう。
このたった一例について、今度は、「玉」に区別がつく、という条件の下で場合の数を計算し、そのうえで、他に同じく「状態II」に該当するものが、上の例示以外にいくつあるかを考慮し、その分だけ掛け合わせなければならないわけである。
「区別のつく赤玉」が4個あり、これを、(左1,左2,左3,右1)の4か所に並べ、その一つ一つの並べ方に対して、これと「独立」に、
「区別のつく白玉」6個を、(左4,左5,右2,右3,右4,右5)の6か所に並べるのであるから、4!×6!、なのである。このような「例」がいくつあるかといえば、
(左1,左2,左3,左4,左5)の5か所から、「赤玉」を置くべき3か所を選び、これと「独立」に、
(右1,右2,右3,右4,右5)の5か所から、「赤玉」を置くべき1か所を選ぶことになる。だから、5C3×5C1、もちろん、「白玉」について考え、5C2×5C4、としても、当然同じ値になる。
上の(i)の後半で、既に説明になってしまっている。「赤玉」に個性がないのだから、どの「赤玉」であっても同じだ、つまり、どこに置かれているか、だけが、問題なのだから、ただ「ポジション」を、「左」なら5個から3個、「右」なら5個から1個、選べばよい。「赤玉」が決まれば、残りを「白玉」に割り当てるだけで、決定する。だから、5C3×5C1、となる。
「世界」を数えるには、まず「区別がつく」として数え、しかるのち、「区別をつけない」というのなら、重複分を差し引く、のが原則だ!、みたいに大見得を切ってしまったから、ちょっと引っ込みがつかないが(笑)、どうも、この問題に関しては、(ii)を原則として考える方が素直なようにも思えてきた。
無理矢理言い訳をすれば、(i)で求めた、4!×6!×5C3×5C1について、実は、4個の赤玉の並べ方4!、および、6個の白玉の並べ方6!は、重複だ、と言えるから、割るのである、と言ってもいい(笑)。
箱の中のどこに置いてもいいのだから、「置く」以前に、置くべきものを選び出した段階で、話は終わっている。だから、例えば、「左」の箱に入れるべきものとして、「赤玉」を4個から3個、「白玉」を6個から2個、選べばよい。だから、4C3×6C2、となる。
もちろん、「右」の箱について考え、4個の「赤玉」から1個、6個の「白玉」から4個、選ぶ、すなわち、4C1×6C4、としても当然、同じになる。「左」を決めれば、残りが「右」となって自動的に決まってしまう、同じく「右」を決めれば「左」が決まる、からである。
さて、上の、(i),(ii),(iii)は、それぞれ「場合の数」こそ、異なるけれど、各「状態」の持つ場合の数の比は、ぴったり一致しているのである。
I:II:III:IV:Vの比が、いずれも、1:10:20:10:1となっている。確かに、当初の目的、「状態I」から「状態II」を経て「状態III」に至る変化は、「場合の数」が、すなわち「エントロピー」が、増大する方向に沿って進んでいる、と言えそうである。
ところが、この、どちらも区別をつけない、条件では、著しく様子が異なってしまう。「もの」から、「名前」を奪ってしまうと、それは、もはや、数、まさに、「カーディナル数」としてか、把握できなくなるのだ、ということが、よくわかる。
ここでは、「状態II」は、例えば「左(赤3、白2)、右(赤1、白4)」、と言った記法で表されてしまう。「左/右」どちらの箱にも、「玉」は5つまでしか入らない、かつ、「赤玉」は全部で4個、「白玉」は全部で6個、と言う制限を組み込むと、実に、例えば「左」の箱に入れるべき「赤玉」の個数を、変数xとすれば、他の3数も、自動的に(笑)、xのみによって決定されてしまうのである。すなわち、
「左(赤x、白5-x)、右(赤4-x、白6-(5-x))」
ところで、xの取りうる値の定義域は、x=0,1,2,3,4
なるほど、これですべて尽くされているから、それぞれの「状態」は、xという数の取り方、つまり、一通りずつ、ということになってしまう。もちろん、分子の拡散モデル、という目的からは、この「数え方」は度を過ごした抽象化であり相応しくないのだろう。現に、「状態I」から「状態III」で、少しも「場合の数」が増えないのだからね。ここで、それぞれの1という数字を5つの「状態」について加算して、5通り、ということ自体が、ナンセンスにも、思える。でも、どうしてナンセンスなのか?、と、問われれば、それほど簡単でもないような気もする。
という訳で、これ以上深入りもできそうにないから、今回は、終了(笑)。
 →
→
 状態IV
状態IV
 状態V
状態V
